
| A. | 晶体硅没有固定的熔沸点 | |
| B. | 形成晶体硅的速率越快越好 | |
| C. | 可用于X-射线衍射实验来鉴别晶体硅和玻璃 | |
| D. | 晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性 |
分析 A.晶体和非晶体的区别:晶体有固定的熔点,非晶体没有固定的熔点;
B.结晶速率太快可能导致晶体质量下降;
C.X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列就能区分出晶体与非晶体;
D.晶体具有各向异性;
解答 解:A.晶体有固定的熔点,非晶体没有固定的熔点,故A错误;
B.晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,故B错误;
C.晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,x射线衍射可以看到微观结构,所以区别晶体与非晶体最可靠的科学方法是对固体进行x-射线衍射实验,故C正确;
D.晶体硅的形成与晶体的自范性有关,形成的晶体有各向异性,故D错误;
故选C.
点评 本题考查了晶体与非晶体的区别,题目比较简单,注意晶体的结构特点和物理性质.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 在Y、N的最高价氧化物中,Y、N与氧原子之间均为双键 | |
| B. | 一定条件下,Y单质能置换出N单质,M能置换出X单质 | |
| C. | N元素位于元素周期表中第3周期I V族 | |
| D. | 四种元素的原子半径:X<Y<M<N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH3 | B. | CH3CH2CH2CH2OH | C. | CH3CH2CH2OH | D. | CH3CH2OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以确定该微粒为Ne | |
| B. | 对应元素的单质可能是强还原剂 | |
| C. | 对应元素可能是电负性最大的元素 | |
| D. | 对应元素可能位于元素周期表中第13列 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| B. | 气体单质中一定有σ键,可能有π键 | |
| C. | 乙烯与氢气发生加成反应时,乙烯分子中有π键断裂 | |
| D. | 当原子形成分子时,首先形成σ键,可能形成π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 卤族元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
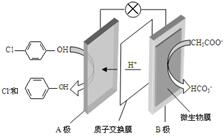 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为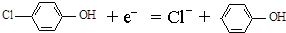 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| D. | B极为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 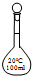 100mL容量瓶 100mL容量瓶 | B. |  100mL集气瓶 | C. |  100mL烧瓶 | D. |  100mL滴瓶 100mL滴瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水,SO3-浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HSO3-浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HSO3-浓度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com