
【题目】下列转化属于取代反应的是( )
A.苯→环已烷
B.乙酸→乙酸乙酯
C.乙烯→乙醇
D.乙醇→乙醛
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】根据题意回答问题:
(1)中和热的测定所需的玻璃仪器有:大小烧杯、量筒、温度计、 ;
已知:0.55 mol·L-1 HCl和0.50 mol·L-1的NaOH溶液各50 mL反应放出热量为1.42kJ,写出该反应的中和热的热化学方程式: 。
(2)101kpa时,1克乙醇(CH3CH2OH)液体完全燃烧生成稳定氧化物放出热量akJ,写出乙醇燃烧热的热化学方程式: 。
(3)已知H-H、O=O和O-H键的键能分别为436 kJ/mol、498 kJ/mol和463 kJ/mol,2H2O(g) = 2H2(g)+ O2(g) ΔH2= 。
(4)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g ![]() CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g ![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为: 。
(5)① 25℃时,浓度均为0.1 mol/L的①氨水②氢氧化钠溶液③盐酸溶液④醋酸溶液,其c(H+)由大到小排列的顺序为: (用序号填空)。
② 95℃时,水中的H+的物质的量浓度为10-6 mol·L-1,若把0.01 mol的NaOH固体溶解于95℃水中配成1 L溶液,则溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有0.1 mol·L-1醋酸溶液10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
①电离程度增大 ②c(CH3COOH)增大 ③CH3COO-数目增多 ④c(H+)增大
⑤导电性增强 ⑥![]() 增大 ⑦c(OH-)增大
增大 ⑦c(OH-)增大
A.①②③⑦ B.①③⑤⑥ C.①③⑥⑦ D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二十世纪化学合成技术的发展对人类健康和生活质量的提高作出了巨大贡献。下列各组物质全部由化学合成得到的是( )
A. 玻璃 纤维素 青霉素 B. 尿素 食盐 聚乙烯
C. 涤纶 洗衣粉 阿司匹林 D. 石英 橡胶 磷化铟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M。其物质的量浓度之比为c(NO3-)∶c(SO42-)∶c(Fe3+)∶c(H+)∶c(M)=2∶3∶1∶3∶1,则M可能是:
A.Al3+ B.Cl- C.Mg2+ D.Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组准备在实验室配制100mL1.0mol·L-1的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制100mL1.0mol·L-1的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是______________________。
(2)若用10 mol·L-1的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_______mL。
(3)配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是__________。
A.定容摇匀后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
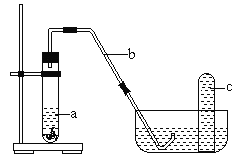
① 反应初期液体a逐渐变为蓝色是由于反应生成了____________(填化学式)。
② 导致红棕色气体在试管c中颜色消失的反应方程式为____________________。
③ 你能否通过该实验初期现象得出1.0mol·L-1的硝酸与铜片反应直接生成红棕色NO2的结论?_________(填“能”或“不能”),理由是 __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作催熟剂的物质除乙烯外,还有氯酸镁。实验室制备少量氯酸镁晶体【Mg(ClO3)2·6H2O】的流程如下:
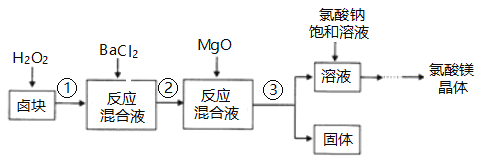

(1)步骤③的操作名称是___________,该步分离出的固体中含有多种成分,任写出一种成分的化学式____________________。
(2)用双氧水溶解卤块,H2O2的主要作用是___________________。
(3)加入饱和氯酸钠溶液发生的主要反应的反应类型是_________________(填四大基本反应类型)。
(4)若卤块中MgCl2·6H2O含量为81.2%,用10L饱和氯酸钠溶液(其中溶质利用率为90%),理论上可以制得氯酸镁晶体的质量是___________(用带a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
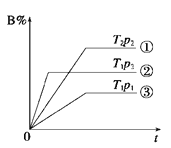
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2、CS2、COS是由C、O、S三种元素形成的结构相似的化合物。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是_____________(填序号)
A.亚硫酸溶液加入Na2CO3溶液中,产生气泡
B.氧化性:浓H2SO4>H2CO3
C.CS2中碳元素为+4价,硫元素为—2价
D.SO2有较强还原性,而CO2无还原性
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。
① 羰基硫的结构式为:________________。沸点:CO2_________COS(填“大于”或“小于”),说明原因_____________________。
②下列有关羰基硫的推测肯定不正确的是_________________
A.COS分子中,所有原子都满足8电子的稳定结构
B.COS分子是含有极性键的非极性分子
C.COS分子中三个原子处于同一直线上
D.COS可能在O2中燃烧
③ 羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下图:

已知A是一种盐,则A的化学式为________;气体单质a为____________________.
(3)在恒容密闭容器中,CO和H2S混合加热生成羰基硫的反应为CO(g)+H2S(g)![]() COS(g)+H2(g),反应前CO和H2S的物质的量均为10mol,平衡后CO的物质的量为8mol,回答下列问题:
COS(g)+H2(g),反应前CO和H2S的物质的量均为10mol,平衡后CO的物质的量为8mol,回答下列问题:
①升高温度,H2S浓度增加,表明该反应是__________________反应(填“放热”或“吸热”)。
②平衡时,继续通入CO10mol和H2S10mol,一段时间后再次达到平衡,此时H2S的转化率_____(填“增大”“减小”或“不变”)
(4)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是____________
A.容器内气体密度保持不变
B.CO、H2S、COS、H2的浓度均不再变化
C.c(H2)=c(H2S)
D.v(H2)正=v(H2S)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com