
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |

 .
.分析 由元素在周期表中的位置可知,①为N,②为O,③为F,④为Na,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,
(1)在这些元素中,化学性质最不活泼的为稀有气体元素Ar;
(2)根据地壳中元素的含量判断;
(3)②与④的单质在加热条件下反应生成一种淡黄色固体,为过氧化钠;
(4)根据元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,元素的金属性越强,最高价氧化物对应的水化物的碱性越强,据此判断;
(5)⑤的单质为铝,与氢氧化钠溶液反应生成氢气和偏铝酸钠;
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)以上元素中只有Ar的最外层电子数为8,性质不活泼,最稳定,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)地壳中元素的含量较多的有O、Si、Al、Ca,则地壳中含量最多的元素是O,故答案为:O;
(3)②与④形成的化合物为Na2O2,为离子化合物,其电子式为 ,故答案为:
,故答案为: ;
;
(4)以上元素中最高价氧化物对应的水化物中酸性最强的为HClO4,碱性最强的为NaOH,呈两性的氢氧化物为Al(OH)3,故答案为:HClO4;NaOH;Al(OH)3;
(5)⑤为Al,与NaOH溶液反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置是解答本题的关键,难度不大,注意化学用语的使用来解答.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
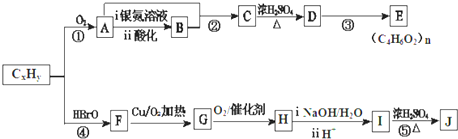
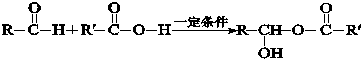
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成. |
| E | ①由C、H、O三种元素组成;②球棍模型为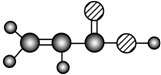 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 选用试剂 |
| A | 探究Cl2、Br2、I2的氧化性强弱顺序 | 氯水、溴水、KI溶液 |
| B | 探究化学反应的能量变化 | Ba(OH)2•8H2O、NH4Cl晶体 |
| C | 证明海带灰中含有碘元素 | 海带灰、稀硫酸、3%的H2O2溶液、淀粉溶液 |
| D | 证明淀粉是否水解 | 淀粉溶液、稀硫酸、NaOH溶液、银氨溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加H2的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 体积不变,充入氮气使容器压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵盐都易溶于水 | |
| B. | 由于易溶,Na+、K+、NH4+都不可能在相关离子方程式中出现 | |
| C. | NH4Cl的分解与NH3、HCl的化合不属于可逆反应 | |
| D. | 铵盐都能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物 | B. | 氧气 | C. | 水 | D. | 氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放在无色透明细口瓶中 | B. | 置于冷暗处 | ||
| C. | 置于通风透光处 | D. | 加入少量MnO2或FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
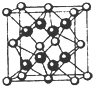 已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com