
 请完成下列各题
请完成下列各题分析 (1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;该分子中中心原子价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断其空间构型;
(2)HCN结构式为H-C≡N,共价单键为σ键,共价三键中一个σ键、两个π键;该分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式;
(3)Cr是24号元素,其原子核外有24个电子,原子核外有多少个电子,其电子就有多少种运动状态;根据构造原理书写Cr原子核外电子排布式;
(4)利用均摊分计算钙离子、过氧根离子个数,根据钙离子和过氧根离子个数比确定其化学式.
解答 解:(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,则C、O、F原子第一电离能大小顺序是F>N>O;该分子中中心原子价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论知其空间构型为V形,故答案为:F>N>O;V形;
(2)HCN结构式为H-C≡N,共价单键为σ键,共价三键中一个σ键、两个π键,所以该分子中含有2个σ键、2个π键;该分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp,
故答案为:2;2;sp;
(3)Cr是24号元素,其原子核外有24个电子,原子核外有多少个电子,其电子就有多少种运动状态,所以该原子中核外电子有24种运动状态;根据构造原理书写Cr原子核外电子排布式为[Ar]3d54s1,
故答案为:24;[Ar]3d54s1;
(4)该晶胞中钙离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,过氧根离子个数=1+12×$\frac{1}{4}$=4,所以钙离子和过氧根离子个数之比=4:4=1:1,其化学式为CaO2,故答案为:CaO2.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子核外电子排布式的书写、原子杂化方式判断、元素周期律等知识点,侧重考查学生分析判断及计算能力,熟练掌握价层电子对互斥理论、构造原理、均摊分等知识点,题目难度中等.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:多选题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe | ||
| C. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | D. | KCl+Ag NO3═KNO3+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
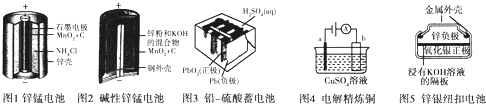
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
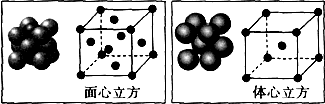
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
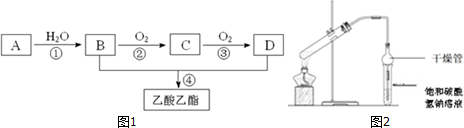
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
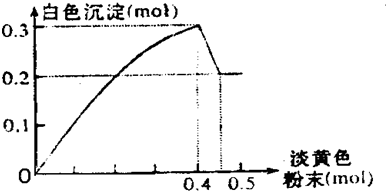
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温高压 | B. | 低温低压 | C. | 高温高压 | D. | 使用合适催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com