
 (2012?北京)用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( ) (2012?北京)用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
|


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
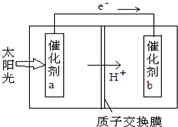 (2012?北京)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
(2012?北京)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
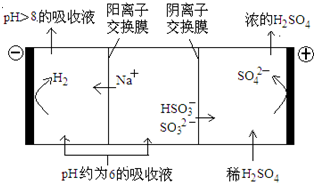 (2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO/CuCl3 | 400℃ |



 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 |
实验I | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生; 一段时间后,溶液逐渐变黑; 试管壁附着有银镜 |
| 实验II | 2mL银氨溶液和数滴浓氨水 | 有气泡产生; 一段时间后,溶液无明显变化 |
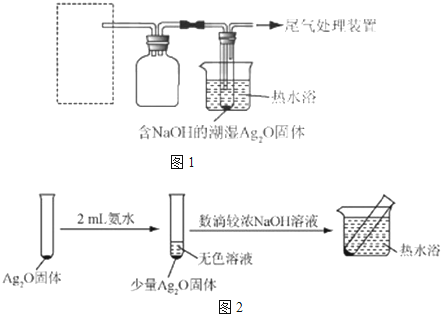
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com