
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
分析 A.0.1mol•L-1的醋酸加水稀释,氢离子浓度减小;
B.KW只与温度有关;
C.体积、pH均相同的醋酸和盐酸,醋酸的浓度大;
D.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大.
解答 解:A.醋酸加水稀释c(H+)减小,c(OH-)增大,则$\frac{c({H}^{+})}{c(O{H}^{-})}$减小,故A正确;
B.向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw只与温度有关,则Kw不变,故B错误;
C.醋酸为弱电解质,等pH时,醋酸浓度大,反应速率大,用时少,故C错误;
D.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大,消耗的氢氧化钠的体积偏大,则V1>V2,故D错误.
故选A.
点评 本题综合考查弱电解质的电离以及平衡移动的影响因素,注意弱酸溶液在稀释时溶液中离子浓度的变化,题目难度中等,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题
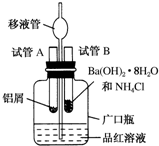 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始时,正反应速率最大,逆反应速率为零 | |
| B. | 随着反应的进行,正反应速率逐渐减小,最后为零 | |
| C. | 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 | |
| D. | 随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com