
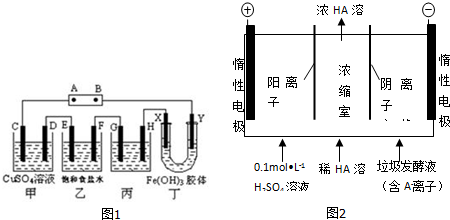
分析 (1)①同周期元素从左至右核电荷数逐渐增多,原子半径逐渐减小非金属性增强;
②CN-能够被氧气氧化成HCO3-,同时生成NH3,根据所给反应物和生成物判断应有水参与;
(2)①电解饱和食盐水时,阴极电极反应2H++2e-=H2↑,H+放电破坏了水的电离平衡,使溶液中的c(OH-)>c(H+),溶液呈碱性,使酚酞呈红色,所以F极为阴极,据此回答;
②电解硫酸铜生成氧气和硫酸、铜;
③精炼铜时,粗铜作阳极,粗铜有杂质,其中有的杂质比Cu先失电子;
④胶体有电泳现象,Fe(OH)3胶体中胶粒带正电;
(3)在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=0.5n(乳酸),据此计算.
解答 解:(1)①C和N同周期,C在N的左边.同周期元素从左至右核电荷数逐渐增多,原子半径逐渐减小,核对最外层电子的引力逐渐减弱,非金属性N>C;故答案为:>;
②CN-能够被氧气氧化成HCO3-,同时生成NH3,根据所给反应物和生成物判断应有水参与,该反应的离子方程式为2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$ 2HCO3-+2NH3;故答案为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$ 2HCO3-+2NH3;
(2)①电解饱和食盐水时,阴极电极反应2H++2e-=H2↑,H+放电破坏了水的电离平衡,使溶液中的c(OH-)>c(H+),溶液呈碱性,使酚酞呈红色,所以F极为阴极,对应的外电源B极为负极,A极为正极;故答案为:负极;
②电解硫酸铜生成氧气和硫酸、铜,即总反应:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
③精炼铜时,粗铜作阳极,粗铜有杂质,其中有的杂质比Cu先失电子,导致此时溶液中的Cu+浓度下降,等变成Cu失电子时,Cu2+浓度就不再变化了;④胶体有电泳现象,Fe(OH)3胶体中胶粒带正电,故胶粒向外电源负极B方向移动,即Y极附近红褐色变深.故答案为:变小;
④装置丁会发生胶体的电泳现象,氢氧化铁胶体中的胶粒带正点,会移向阴极,即Y极附近溶液颜色变深,故答案为:Y极附近溶液颜色变深;
(3)反应过程中产生的乳酸的质量是0.400 L(145g/L-10g/L)=54g.则乳酸的物质的量是$\frac{54g}{90g/mol}$=0.6mol;因为在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=$\frac{1}{2}$n(乳酸)=0.3mol,其在标准状况下体积是0.3mol×22.4L/mol=6.72L,故答案为:6.72.
点评 本题考查学生电解池的工作原理自己电极反应式的书写和反应现象的判断知识,注意知识的迁移应用是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
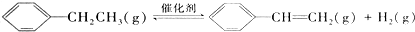
| 窗口编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
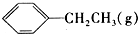 | 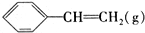 | H2(g) | ||
| 1 | 380 | 0.10 | 0.60 | 0.060 |
| 2 | 380 | 0.20 | ||
| 3 | 230 | 0.10 | 0.050 | 0.050 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达到平衡时,容器I中的H2体积分数比容器Ⅱ中的小 | |
| C. | 容器I中反应达到平衡所需的时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅲ中充入0.10mol (g)、0.10mol (g)、0.10mol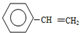 (g)和0.10mol H2,则反应向逆反应方向进行 (g)和0.10mol H2,则反应向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中[Na+]增大,有O2放出 | B. | 溶液PH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中PH值不变,有O2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

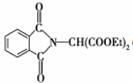 .
.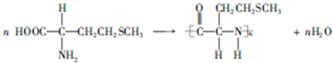 .
.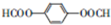 .
.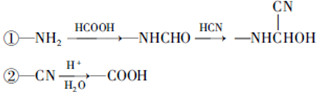
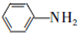 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物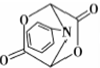 的流程如下:
的流程如下: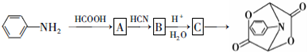
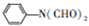 ,C
,C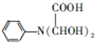 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com