
【题目】A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,写出AB2的电子式______________,分子中有______________个σ键,______________个π键。
(2)当n=3时,A单质形成的晶体属于______________晶体;
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是______________(用元素符号表示)。
(4)已知某红紫色络合物的组成为CoCl35NH3H2O。该络合物中的中心离子钴离子在基态时核外电子排布简式为______________;
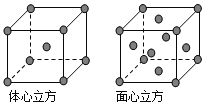
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为______________。
【答案】(1)![]() ;
;
(2)原子;
(3)P>S>Si;
(4)1s22s22p63s23p63d6(或[Ar]3d6);
(5)1:2
【解析】试题分析:A、B、C、D为前四周期元素,B元素的最外层电子数是其电子层数的3倍,最外层电子数不超过8个,所以该元素为O元素,C元素原子的M电子层的P亚层中有3个未成对电子,则C是P元素,D元素原子核外的N层中只有2对成对电子,则D的核外电子排布式为:1s22s22p63s23p4,则D是S元素。
(1)当n=2时,A元素的原子价电子排布为ns2np2,则A为C元素,AB2为CO2,其电子式为![]() ,二氧化碳中碳氧之间是双键,其中有一个是σ键,一个是π键,所以每个二氧化学碳中含有2个σ键和2个π键,故答案为:
,二氧化碳中碳氧之间是双键,其中有一个是σ键,一个是π键,所以每个二氧化学碳中含有2个σ键和2个π键,故答案为:![]() ;
;
(2)当n=3时,A元素的原子价电子排布为ns2np2,则A为Si元素,A单质形成的晶体属于原子晶体,故答案为:原子;
(3)若A元素的原子价电子排布为3s23p2,则A为Si元素,同周期元素从左向右,第一电离能增大,但Si、P、S三种元素中,由于P元素的最外层电子处于半满状态,是一种稳定结构,其第一电离能高于同周期相邻的元素,所以Si、P、S的第一电离能由大到小的顺序是P>S>Si,故答案为:P>S>Si;
(4)钴离子的化合价是+3价,钴离子核外有24个电子,其基态时核外电子排布式为1s22s22p63s23p63d6,故答案为:1s22s22p63s23p63d6(或[Ar]3d6);
(5)体心立方晶胞中含有Fe原子的个数为8×![]() +1=2,面心立方晶胞中实际含有的Fe原子个数为8×
+1=2,面心立方晶胞中实际含有的Fe原子个数为8×![]() +6×
+6×![]() =4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2,故答案为:1:2。
=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2,故答案为:1:2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液、胶体
D.工业上电解熔融的MgCl2,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有 ( )
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的物质和水混合后摇动即可制冷,该化学物质是
A.氯化钠 B.固体硝酸铵 C.生石灰 D.固体氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于如图所示实验的说法正确的是
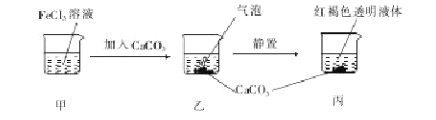
A.甲、丙两液体均可产生丁达尔现象
B.乙中产生的气泡使BaCl2溶液变浑浊
C.若忽略溶液体积的变化,则烧杯中c(Cl-)不变
D.若将CaCO3换成CaSO4,也可得到相同的实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 乙烯可以作水果的催熟剂
B. 石油分馏属于化学变化
C. 苯燃烧时火焰明亮,伴有浓烟
D. 冶炼金属是将金属从其化合物中还原出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图如图1可简单表示如下,其中配位键和氢键均采用虚线表示。
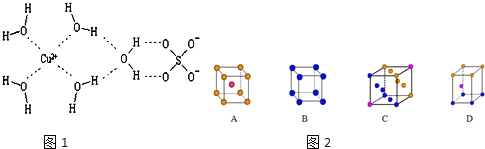
(1)金属铜采用下列______________堆积方式。
(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有______________(填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为______________;
(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色溶液.写出此蓝色沉淀溶解的离子方程式:______________;
(4)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色.该反应在有的教材中用方程式FeCl3+3KSCN═Fe(SCN)3+3KCl表示.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合.请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供______________,SCN-提供______________,二者通过配位键结合.
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色.含该离子的配合物的化学式是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com