
| A. | 1:1:3 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:2 |
分析 BaCl2溶液恰好可使相同物质的量浓度的硫酸铁、硫酸锌和硫酸钾三种溶液中的SO42-完全转化为BaSO4沉淀,则硫酸根离子的物质的量相同,由n=cV来计算三种溶液的浓度体积之比.
解答 解:BaCl2溶液恰好可使相同物质的量浓度的硫酸铁、硫酸锌和硫酸钾三种溶液中的SO42-完全转化为BaSO4沉淀,则硫酸根离子的物质的量相同,
所以SO42-~$\frac{1}{3}$Fe2(SO4)3~ZnSO4~K2SO4,
三种溶质的物质的量之比为:$\frac{1}{3}$:1:1=1:3:3,
由n=cV可知,
浓度相同,物质的量与体积成正比,
则三种硫酸盐溶液的体积之比为1:3:3,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确硫酸根离子与硫酸盐的化学式的关系是解答本题的关键,注意掌握物质的量浓度的概念及计算方法.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当a和b用导线连接时,溶液中的SO42-向铜片附近移动 | |
| B. | 将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 | |
| C. | 当a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑ | |
| D. | a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
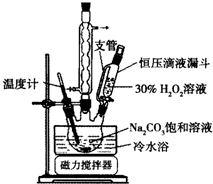 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水,浓H2SO4 | B. | 浓H2SO4,溴水 | ||
| C. | 溴水,浓H2SO4 | D. | 浓H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | KIO3溶液中滴加HI,再滴加淀粉溶液 | 溶液出现蓝色 | KIO3氧化性比I2强 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 将一小块Na放入乙醇中 | 产生气泡 | 乙醇含有羟基 |
| D | 沿杯壁向水中加浓H2SO4,搅拌 | 烧杯外壁发烫 | 浓硫酸溶于水放热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com