
【题目】亚硝酰氨(NOCl)是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点-64.5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)将5g经300℃下干燥了3h并研细的KCl粉末装 50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0.002molNO2。反应12~36min即可完成,NO2红棕色消失,出现黄色亚硝酰氯,同时还得到一种盐,该盐的化学式为_____________,氯化钾需要“干燥”的原因是_____________________________。
(2)实验室可由氯气与一氧化氮在常温常压下合成亚硝酰氯,装置如图所示:
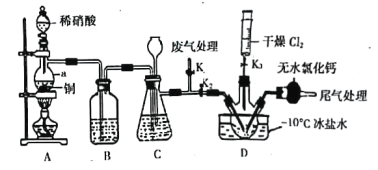
①仪器a的名称为____________________________;
②B装置的作用是____________________________;
③实验开始时,先打开K1,关闭K2、K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________________时,打开K3向装置D三颈瓶中推入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl。
(3)测定产品纯度:取(2)中w g D中液态产品溶于蒸馏水,配制成250 mL溶液;用酸式滴定管准确量取25.00 mL所配制溶液于锥形瓶中,滴加几滴K2CrO4溶液作指示剂,用滴定管盛装c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。(已知:Ag2CrO4为砖红色固体,忽略杂质参与反应)
①盛装AgNO3标准溶液的滴定管是_____________(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________。
②该产品纯度为_____________(用代数式表示)。
【答案】KNO3 NOCl遇水易水解,NO2与水反应 蒸馏烧瓶 除去NO中的NO2 红棕色气体完全消失 酸式 溶液中恰好出现砖红色沉淀且半分钟内不消失 ![]()
【解析】
实验开始时,先打开K1、K2,关闭K3,打开分液漏斗活塞滴入适量稀硝酸,和铜反应生成NO,由于装置中有空气,所以生成的NO会被氧化成红棕色的NO2,通过装置B中水除去挥发的硝酸及NO和空气中氧气反应生成的二氧化氮,此时装置C的作用为储存A中产生的NO气体,同时长颈漏斗插入液面以下可以防止体系内压强过高,因为C中也有空气,所以C中也会先生成NO2,至C中红棕色完全消失后,再打开K3,向D装置中通入干燥纯净的Cl2,当D中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl;装有无水CaCl2的干燥管其作用为防止水蒸气进入D中,防止NOC1水解;该滴定原理是通过硝酸银标准液来滴定产品中的Cl元素的量来确定产品的量,滴定过程中先发生Cl-+Ag+=AgCl↓,当氯离子全部沉淀后银离子和K2CrO4反应生成Ag2CrO4,溶液会出现砖红色沉淀。
(1)NO2中N的化合价为+4,NO2与KCl反应生成的NOCl中N的化合价为+3价,化合价降低,根据氧化还原反应规律,需要有元素化合价升高,根据元素价态变化规律可知该反应中N元素发生歧化,即化合价既升高又降低,可以判断盐为硝酸钾,化学式为KNO3;根据题目信息,干燥的目的是防止生成的氯化亚硝酰遇水反应,降低产率,且防止NO2与水反应;
(2)①根据a的结构特点可知其为分液漏斗;
②根据分析可知装置B的主要作用是除去NO中混有的NO2;
③根据分析可知需要观察到C中红棕色气体完全消失时再进行下一步操作;
(3)①硝酸银溶液由于银离子的水解会显酸性,且见光易分解,所以需要用酸式棕色滴定管;根据分析可知滴定终点现象为:溶液中恰好出现砖红色沉淀且半分钟内不消失;
②根据发生的反应可知存在数量关系NOCl~Cl-~AgNO3,则n(NOCl)=n(AgNO3)=cV×10-3mol,所以产品的纯度为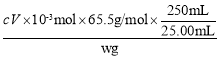 ×100%=
×100%=![]()


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3 时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6 的结构式为_____;(标出配位键)其中 Al 的配位数为_________。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____种。
(4)Co2+的价电子排布式_________。NH3 分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____(填“较大”,“较小”或“相同”),解释原因_____。
(5)已知 CrO5 中铬元素为最高价态,画出其结构式:_____。
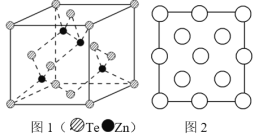
(6)阿伏加德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加德罗常数 NA=_____mol-1(列计算式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.  水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.  CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图:
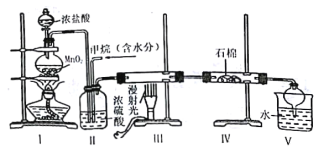
下列说法不正确的是
A.依据装管Ⅰ中的现象控制气流的速度
B.分离装置V中盐酸的最佳操作方法是分液
C.装置Ⅳ的石棉中可加入一些氢氧化钠粉末
D.实验过程中可观察到装置Ⅲ中硬质玻璃管内壁有附着的油珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如下:

已知: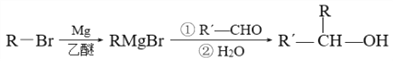
回答下列问题:
(1)A的结构简式是___________,E的化学名称是____________。
(2)由B生成C的化学方程式为______________________。
(3)G的结构简式为__________________。合成丁苯酞的最后一步转化为:
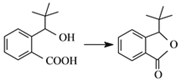 ,则该转化的反应类型是_______________。
,则该转化的反应类型是_______________。
(4)有机物D的溴原子被羟基取代后的产物J有多种同分异构体,其中含有苯环的同分异构体有______种(不包括J),其核磁共振氢谱吸收峰最多的结构简式为_________。
(5)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:______________。
的合成路线:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
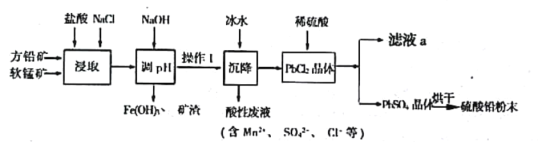
已知:
i.PbCl2 难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
iii.Ksp(PbSO4) =1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS 发生反应生成PbCl2和S的化学方程式为___________________;
(2)沉降操作时加入冰水的作用是____________________________;
(3)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是___________(填字母)
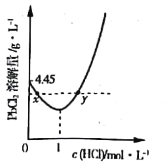
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+) 不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随HCl浓度增大,PbCl2 溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是_________________________________,操作I的方法是____________________;PbCl2“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=_________________________;
(5)滤液a经过处理后可以返回到__________________工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂—三盐基硫酸(3PbO·PbSO4·H2O),写出该反应的反应方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C. Na2O2粉末(Na2O),将混合物在氧气中加热
D. Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼在冶金、核工业、农业、高新材料等方面都有重要的应用,一种利用硼镁矿制取粗研的工艺流程:
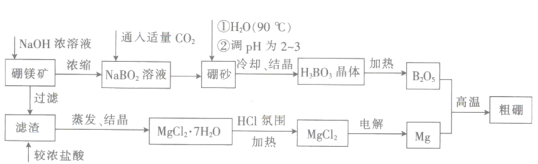
已知:硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7)·10H2O。
回答下列问题:
(1)硼镁矿要粉碎处理,其目的是_______,NaOH浓溶液与硼镁矿反应的化学方程式为__________________________________(不考虑杂质参与反应)。
(2)实验室过滤操作中要用到的玻璃仪器包括烧杯、_______、______。洗涤沉淀的操作方法为_____________________________________。
(3)试解释流程中生成无水MgCl2需在HCl氛围中进行的原因:___________________。
(4)已知H3BO3为一元弱酸,其与NaOH反应的化学方程式为NaOH+H3BO3=Na[B(OH)4],写出H3BO3的电离方程式:_________________________________________。
(5)实验测得一定质量的H3BO3在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。
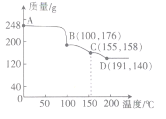
①C对应的物质可表示为2B2O3·nH2O,则n=_______
②写出C到D过程中发生反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)2C(g) △H=﹣Q kJ/mol,有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ。在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=4Q2。下列叙述不正确的是( )
A. 乙中C的转化率为20%
B. Q1+Q2=Q
C. 达到平衡后,再向乙中加入0.2 molA、0.6molB、1.6molC,平衡向正反应方向移动
D. 乙中的热化学反应方程式为2C(g)A(g)+3B(g) △H=+4Q2kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com