
(18分) 高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO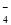 +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
② MnO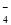 +CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②配平后2种反应物前面的系数: MnO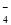 + CuS+…..
+ CuS+…..
II:在稀硫酸中,MnO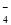 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO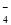 +8H++5e-===Mn2++4H2O
+8H++5e-===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是 mol。
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(5)用软锰矿制备K2MnO4的化学方程式是: 。
(6)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是 。(用“>”“<”或“=”表示)。
I:(6分)(1)d (3分) (2)6 5(3分)
II:(4分 (3)6.02×1023(2分,写NA也对) (4)2.5(2分)
III:(7分) (5)KClO3+3MnO2+6KOH  3K2MnO4+KCl+3H2O(3分)
3K2MnO4+KCl+3H2O(3分)
(6)1∶2(3分) KMnO4>K2MnO4>MnO2(2分)
【解析】
试题分析:(1)①中,a项铜元素的化合价由+1升到+2价,硫元素的化合价由-2升到+4价,均被氧化,正确;b项,设氧化剂的物质的量为x,还原剂的物质的量为y,则5x=(2+6)y, ,正确;c项,根据b项,当生成5 mol SO2时,转移电子40 mol,所以当有0.1 mol SO2生成时,转移电子0.8 mol,正确;d项,氧化还原反应中还原剂的还原性强于还原产物的还原性,则根据方程式,还原性Cu2S>Mn2+,错误,答案选d。
,正确;c项,根据b项,当生成5 mol SO2时,转移电子40 mol,所以当有0.1 mol SO2生成时,转移电子0.8 mol,正确;d项,氧化还原反应中还原剂的还原性强于还原产物的还原性,则根据方程式,还原性Cu2S>Mn2+,错误,答案选d。
(2)由②可得,锰元素化合价由+7降到+2,硫元素化合价由-2升到+4,根据得失电子守恒得:6MnO+5CuS+…。
(3)由H2O2-2e-===2H++O2↑得,当有0.5 mol H2O2参加此反应,转移电子个数为NA。
(4)方程式可改写成:2KMnO4+5H2O2+3H2SO4==K2SO4+2MnSO4+5O2↑+8H2O和2H2O2===2H2O+O2↑的加和形式,所以被1 mol KMnO4氧化的H2O2是2.5 mol。
(5)利用电子守恒配平6KOH+KClO3+3MnO2===3K2MnO4+KCl+3H2O;
(6)根据方程式3MnO +4H+===MnO2+2MnO
+4H+===MnO2+2MnO +2H2O可知,氧化剂与还原剂的物质的量之比为1∶2。氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则由上述方程式可知氧化性KMnO4>K2MnO4>MnO2。
+2H2O可知,氧化剂与还原剂的物质的量之比为1∶2。氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则由上述方程式可知氧化性KMnO4>K2MnO4>MnO2。
考点:考查氧化还原反应的有关判断与计算


科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
下列说法不正确的是( )。
A.用加热法可除去Na2CO3中的NaHCO3
B.Na2CO3的热稳定性大于NaHCO3
C.可用石灰水区分Na2CO3与NaHCO3溶液
D.小苏打可中和胃酸、热纯碱可除去油污
查看答案和解析>>
科目:高中化学 来源:2015届山东省乐陵市高三10月初检测化学试卷(解析版) 题型:选择题
下列由相关实验现象所推断出的结论中,正确的是
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少,说明二者均发生升华
C.Fe与稀HNO3溶液、稀H2SO4溶液反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源:2015届山东省临沂市高三10月份月考化学试卷(解析版) 题型:选择题
下列装置或操作能达到相应实验目的的是
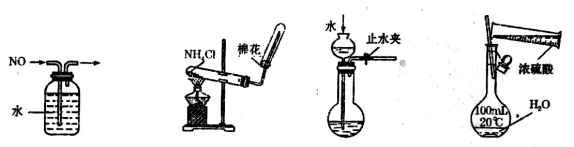
A.排水集气法收集NOB.实验室制取氨气 C.检查装置气密性D.配制稀硫酸
查看答案和解析>>
科目:高中化学 来源:2015届山东省临沂市高三10月份月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.不慎将硫酸沾在皮肤上,立刻用干布擦净,然后用氢氧化钠溶液冲洗
C.实验室配制一定物质的量浓度的溶液,定容时仰视刻度线,所配制溶液浓度偏大
D.某溶液中加入BaC12溶液,产生了不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+
查看答案和解析>>
科目:高中化学 来源:2015届山东淄博市高三上学期第二次诊断性检测理综化学试卷(解析版) 题型:选择题
下列离子反应方程式表示正确的是
A.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+===4Fe3++2H2O
C.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015届安徽省黄山市高三第一次月考化学试卷(解析版) 题型:实验题
(11分)二氧化铈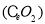 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含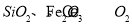 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
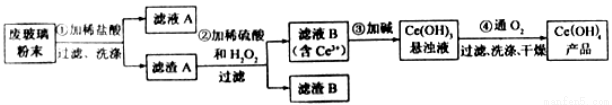
(1)洗涤 滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
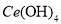 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol?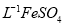 标准溶液滴定至终点时(铈被还原为
标准溶液滴定至终点时(铈被还原为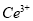 ),消耗25.00mL标准溶液,该产品中
),消耗25.00mL标准溶液,该产品中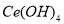 的质量分数为 。
的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高二上学期期中考试化学试卷(解析版) 题型:填空题
(9分)含苯酚的工业废水处理的流程图如下所示:
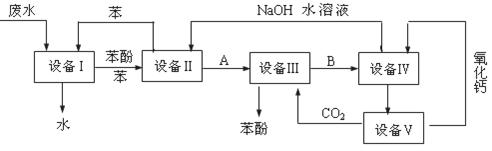
(1)上述流程里,设备Ⅰ中进行的是______________操作(填操作名称),实验室里这一步操作可以用_______________进行(填仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是__________,由设备Ⅲ进入设备Ⅳ的物质B是
(3)在设备Ⅲ中发生反应的化学方程式为 。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和 ,通过 操作(填操作名称)可使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、 、 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高一上学期期中考试化学试卷(解析版) 题型:选择题
有质量分数为a的氨水溶液,加入等质量的水稀释后,浓度从C1 mol?L﹣1成为C2mol?L﹣1,下列说法正确的是
A.C1=2C2 B.C1>2C2 C.C1<2C2 D.C1=a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com