
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
B.室温下,28.0 g乙烯和丁烯的混合气体中含有的碳原子数目为2NA
C.标准状况下,2.24 L CO2与足量的Na2O2充分反应,转移电子总数为0.2 NA
D.25 ℃时,pH=1的1.0 LH2SO4溶液中含有H+的数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A===H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填选项字母),原因是________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)= 1.0×10-14
1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________(填选项字母)。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废
。为了使废 水的排放达标,进行如下处理:
水的排放达标,进行如下处理:
Cr2O
 Cr3+、Fe3+
Cr3+、Fe3+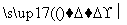 Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为___________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为______________。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是( )
A.将一定量的氯气通入30 mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
B.实验室可以配制一种仅含Al3+、K+、SO42-、NO3-这4种离子(不考虑来源于水电离的离子)的溶液,且4种离子的浓度均为1mol/L
C.HCl、FeCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到
D.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3
ΔH=—92.4 KJ/mol,则N≡N键的键能是( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s),ΔH=+234.1kJ••mol-1
CO2(g)+2Fe(s),ΔH=+234.1kJ••mol-1
C(s)+O2(g)=CO2(g);ΔH=-393.5kJ••mol-1
则2Fe(s)+ 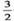 O2(g)=Fe2O3(s)的ΔH是( )
O2(g)=Fe2O3(s)的ΔH是( )
A、-824.4 kJ••mol-1 B、-627.6kJ••mol-1 C、-744.7kJ••mol-1 D、-169.4kJ••mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 g NaOH溶于水配成50 mL溶液,取出5 mL,这5 mL溶液的物质的量浓度是 ( )
A.2 mol/L B.1 mol/L C.0.1 mol/L D.0.05 mol/
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ | Ag+ | Mg2+ | Cu2+ | Al3+ | NH |
| 阴离子 | Cl- | CO | NO | SO | SiO | I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是______。
( 2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈________性,原因是________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为_____________________________________________________
___________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com