
| 1 |
| 2 |


科目:高中化学 来源: 题型:
本题包括两个小题,共16 分。
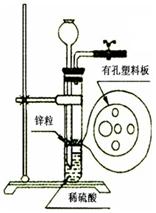
Ⅰ.某同学在实验室里利用一定量的Zn按右图所示的装置制取一定量的H2。在实验中他发现稀硫酸溶液不足而再无其他酸溶液可加入,经仔细思考后他通过长颈漏斗加入适量的某试剂完成了实验。下列试剂中他不可能选用的是(填写代码) 。
A.KCl溶液 B.酒精 C.苯 D.四氯化碳
Ⅱ.有甲、乙两学生分别按下面的步骤探究问题:在物质发生化学变化的前后,其总
质量是否发生增加或者减小或者不变?
(1)提出假设:物质发生化学变化的前后,其总质量不变。
(2)设计方案并进行实验:甲设计的实验装置和选用药品如下图A所示,乙设计的实验装置和
选用药品如下图B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
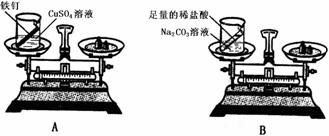
①实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙认为:在化学反应中,生成物总质量与反应物总质量不相等。
②你认为 的结论正确。
③请从宏观的角度分析你认为正确的结论的原因 ;
④请从微观的角度分析你认为正确的结论的原因 ;
⑤请写出上述实验中有关反应的离子方程式
A ,B 。
查看答案和解析>>
科目:高中化学 来源: 题型:
本题包括两个小题。
Ⅰ.(14分)向NaBr和NaI的混合溶液中通入适量的氯气,反应完全后,将溶液蒸干并小心灼烧至恒重,得到固体W。
⑴固体W的可能组成是(填写化学式,可以不填满):
① ②
③ ④
⑵若固体W为纯净物,则氯气通入该混合溶液时所发生化学反应的化学方程式是
⑶现将NaBr和NaI的混合固体5.06g溶于适量水中,通入448 mLCl2(标准状况)充分反应后,将溶液蒸干并小心灼烧至恒重,得到纯净物固体W的质量为2.34g。则原混合物中NaI质量分数是 。
Ⅱ.(6分)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A.加入一定量M B.加入一定量N C.反应温度升高
D.缩小容器体积 E.加入某物质作催化剂 F.分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol?L-1,c(N)=2.4 mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol?L-1,c(N)=a mol?L-1;达到平衡后,M的体积分数为20%,c(P)=2 mol?L-1,则a= mol?L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
本题包括两个小题,共16 分。
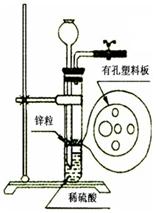
Ⅰ.某同学在实验室里利用一定量的Zn按右图所示的装置制取一定量的H2。在实验中他发现稀硫酸溶液不足而再无其他酸溶液可加入,经仔细思考后他通过长颈漏斗加入适量的某试剂完成了实验。下列试剂中他不可能选用的是(填写代码) 。
A.KCl溶液 B.酒精 C.苯 D.四氯化碳
Ⅱ.有甲、乙两学生分别按下面的步骤探究问题:在物质发生化学变化的前后,其总
质量是否发生增加或者减小或者不变?
(1)提出假设:物质发生化学变化的前后,其总质量不变。
(2)设计方案并进行实验:甲设计的实验装置和选用药品如下图A所示,乙设计的实验装置和
选用药品如下图B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
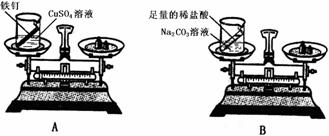
①实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙认为:在化学反应中,生成物总质量与反应物总质量不相等。
②你认为 的结论正确。
③请从宏观的角度分析你认为正确的结论的原因 ;
④请从微观的角度分析你认为正确的结论的原因 ;
⑤请写出上述实验中有关反应的离子方程式
A ,B 。
查看答案和解析>>
科目:高中化学 来源: 题型:
本题包括两个小题。
Ⅰ.(14分)向NaBr和NaI的混合溶液中通入适量的氯气,反应完全后,将溶液蒸干并小心灼烧至恒重,得到固体W。
⑴固体W的可能组成是(填写化学式,可以不填满):
① ②
③ ④
⑵若固体W为纯净物,则氯气通入该混合溶液时所发生化学反应的化学方程式是
⑶现将NaBr和NaI的混合固体5.06g溶于适量水中,通入448 mLCl2(标准状况)充分反应后,将溶液蒸干并小心灼烧至恒重,得到纯净物固体W的质量为2.34g。则原混合物中NaI质量分数是 。
Ⅱ.(6分)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A.加入一定量M B.加入一定量N C.反应温度升高
D.缩小容器体积 E.加入某物质作催化剂 F.分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol?L-1,c(N)=2.4 mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol?L-1,c(N)=a mol?L-1;达到平衡后,M的体积分数为20%,c(P)=2 mol?L-1,则a= mol?L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com