
| A. | m>n | B. | m<n | C. | m=n | D. | 不能确定 |
分析 CH3COOH是弱电解质而在水溶液中部分电离,HCl是强电解质而在水溶液中完全电离,则将[H+]相同的CH3COOH溶液和HCl溶液中c(CH3COOH)>c(HCl),加水稀释过程中促进CH3COOH电离,如果稀释相同的倍数,[H+]醋酸大于盐酸,据此分析解答.
解答 解:CH3COOH是弱电解质而在水溶液中部分电离,HCl是强电解质而在水溶液中完全电离,则将[H+]相同的CH3COOH溶液和HCl溶液中c(CH3COOH)>c(HCl),加水稀释过程中促进CH3COOH电离,如果稀释相同的倍数,[H+]醋酸大于盐酸,如果稀释后两种溶液中[H+]仍然相同,醋酸稀释的倍数应该大于盐酸,即m>n,故选A.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点是解本题关键,侧重考查学生逆向思维能力,采用逆向思维方法分析解答,题目难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液含有次氯酸钠,洁厕灵中含有盐酸,二者混合使用会产生氯气使人中毒 | |
| B. | 输送氯气的管道漏气,可以用浓氨水检验,是因为氯气和氨气发生化合反应生成氯化铵. | |
| C. | 因氯气消毒过的自来水不宜直接用来养金鱼,最好在阳光下晒一段时间 | |
| D. | 氯气和二氧化硫均有漂白性,二者按体积比1:1混合后不能是有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中反应 | ||
| C. | 二氧化硫通入石灰水 | D. | 硫在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
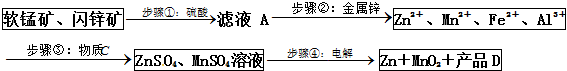
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
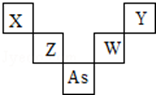 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A. | W的氧化物对应的水化物必是强酸 | |
| B. | X的原子半径比As原子半径小,两者原子序数之差为29 | |
| C. | Z的氧化物可与Y的氢化物水溶液不会发生化学反应 | |
| D. | 图中五种元素均是非金属元素,并且Y的非金属性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从上至下,卤素单质的密度依次增大,碱金属单质的密度也依次增大 | |
| B. | 从上至下,卤素单质的沸点逐渐升高,碱金属单质的熔点逐渐降低 | |
| C. | 除了I2外,其它卤素单质都能将Fe氧化到+3价 | |
| D. | F2不能从NaCl溶液中置换出Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| B. | 家用天然气含有特殊气味的主要原因是开采的天然气未经处理就直接转为民用燃气 | |
| C. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com