
【题目】对于密闭容器中的可逆反应:mX(g)+nY(s)![]() pZ(g) ΔH<0,达到化学平衡后,改变条件,下列表述不正确的是( )
pZ(g) ΔH<0,达到化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如下图所示,在图(1)中A、B两容器里分别收集着两种互不作用的理想气体。压强不变,若将中间活塞打开[如图(2)],两种气体分子立即都占满了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是( )
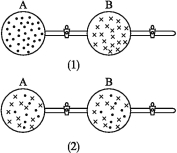
理想气体的自发混合
A.此过程为混乱程度小的向混乱程度大的方向进行的变化过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程从有序到无序,混乱度增大
D.此过程是自发可逆的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2↑+H2O
CH2===CH2↑+H2O
CH2===CH2+Br2→BrCH2CH2Br
可能存在的副反应有乙醇在浓硫酸存在下140℃时脱水生成乙醚。
用少量的溴和足量的乙醇反应制备1,2二溴乙烷的装置如图所示:

乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是________(填序号,下同)。
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)在装置C中应加入___________,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是____________________。
(4)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在________(填“上”或“下”)层。
(5)若产物中有少量未反应的Br2,最好用________洗涤除去。
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,保持压强不变,充入Ar,其正反应速率(A.变快 B.不变 C变慢,填字母代号);该反应向(填正移、逆移或不移).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 和
和 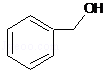 分子组成相差一个﹣CH2﹣,因此是同系物关系
分子组成相差一个﹣CH2﹣,因此是同系物关系
B.![]() 和
和 ![]() 均是芳香烃,
均是芳香烃, ![]() 既是芳香烃又是芳香族化合物
既是芳香烃又是芳香族化合物
C.分子式为C4H8的有机物可能存在4个C﹣C单键
D.分子式为C2H6O的红外光谱图上发现有C﹣H键和C﹣O键的振动吸收,由此可以初步推测:有机物结构简式一定为C2H5﹣OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作(或注意事项)中,主要是出于实验安全考虑的是
A.实验剩余的药品不能放回原试剂瓶 B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查 D.滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定碘盐中KIO3的质量分数并制备少量KIO3 , 进行了如下实验. I.测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O; I2+2Na2S2O3=2Na I+Na 2S4O6
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c molL﹣1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据;重复滴定2次,平均消耗Na2S2O3溶液12.00mL.
(1)步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有 .
(2)步骤三中到达滴定终点时的现象为 .
(3)实验测得此加碘盐中KIO3的质量分数 .
(4)Ⅱ.实验室制备KIO3已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到.该化学小组通过以下装置制备KIO3 . 
装置A中反应的离子方程式为 .
(5)装置B中的试剂为 .
(6)写出装置C中生成KIO3的离子方程式 .
(7)上述实验装置存在一处明显缺陷,请指出 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA
B.将lmol Cl2通入水中,HClO、Cl﹣、ClO﹣粒子数之和为2NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.将CO2通过Na2O2使其增重a克时,反应中转移电子数为 ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com