
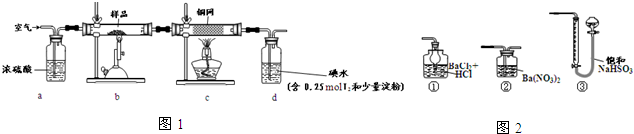
分析 该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;
(2)二氧化硫全部被吸收是实验成败的关键;
(3)已知发生的反应有8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2,I2+SO2+2H2O═H2SO4+2HI,I2+H2S=S↓+2HI,根据消耗50mL 0.2mol/L H2S溶液及其碘单质的物质的量求出CuFeS2的物质的量和质量,再根据样品的质量求出质量分数;去掉c装置气体中二氧化硫在水溶液中会和氧气反应,测定结果偏小;
(4)二氧化硫和单质碘之间发生氧化还原反应,根据消耗碘单质的量可以确定二氧化硫的量,进而确定黄铜矿的纯度;
(5)二氧化碳和二氧化硫均可以和氢氧化钡反应生成白色沉淀,亚硫酸钡易被氧化为硫酸钡.
解答 解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量;故答案为:BD;
(2)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(3)已知发生的反应有8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2,I2+SO2+2H2O═H2SO4+2HI,
取d中溶液的$\frac{1}{10}$置于锥形瓶中,恰好与50mL 0.2mol/L H2S溶液完全反应,根据I2+H2S=S↓+2HI,即剩余I2的量为:0.05mol/L×0.2L×10=0.1mol,
再根据反应方程式I2+SO2+2H2O═H2SO4+2HI,得消耗I2的量为0.25mol-0.1mol=0.15mol,所以生成二氧化硫物质的量为0.15mol,再根据8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2,所以黄铜矿的质量是:0.15mol×$\frac{1}{2}$×184g/mol=13.8g,
所以其纯度是:$\frac{13.8}{23}$×100%=60%,
去掉c装置气体中二氧化硫在水溶液中会和氧气反应,反应的化学方程式为:2SO2+O2+H2O=2H2SO4,测定结果偏小,
故答案为:60%;偏小;
(4)用如图2装置替代上述实验装置d,不能用③,原因是前面通入的空气中也会占据一部分气体体积,所以根据液面上升的高度可以确定生成的量,进而根据元素守恒来确定黄铜矿的纯度,故答案为:②;
(5)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀或BaSO3被氧化成BaSO4.
点评 本题考查了探究黄铜矿的纯度,涉及了实验原理的分析应用、纯度计算、实验方案的评价等知识,题目难度中等,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
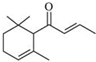 一种从植物中提取的天然化合物α-damascone可用于制作“香水”,其结构为:,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物α-damascone可用于制作“香水”,其结构为:,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验 | |
| D. | 1 mol该化合物完全燃烧消耗19 molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | $\frac{1{0}^{-14-a-b}}{a}$ | C. | $\frac{1{0}^{a+b-14}}{a}$ | D. | $\frac{1{0}^{a-b}}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部由非金属元素组成的化合物中只含共价键 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol,则石墨比金刚石稳定 | |
| D. | 氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S | B. | O2 | C. | SO2 | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
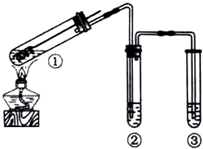
| A. | 为确认CuSO4生成,向①中加水,观察颜色 | |
| B. | 上下移动①中铜丝可控制SO2的量 | |
| C. | ②中选用品红溶液验证SO2的生成 | |
| D. | ③中选用NaOH溶液吸收多余的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com