
| 微粒 | 孤电子对数 | 杂化轨道数 | 中心原子轨道杂化形式 | 微粒的空间构型 |
| SO2 | ||||
| NH4+ | ||||
| CO32- |
 ,故答案为:
,故答案为: ;
;| 1 |
| 2 |
| 1 |
| 2 |
| 微粒 | 孤电子对数 | 杂化轨道数 | 中心原子轨道杂化形式 | 微粒的空间构型 |
| SO2 | 1 | 3 | sp2 | V形 |
| NH4+ | 0 | 4 | sp3 | 正四面体形 |
| CO32- | 0 | 3 | sp2 | 平面三角形 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
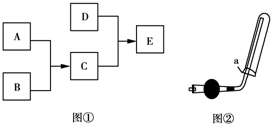 已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如图①所示:
已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如图①所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,且E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 根据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图,其中盐桥内装琼脂饱和KNO3溶液.请回答下列问题:
根据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图,其中盐桥内装琼脂饱和KNO3溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和Na2CO3 HCl和NaHCO3 |
| B、AgNO3和HCl AgNO3和H2SO4 |
| C、BaCl2和Na2SO4 Ba(OH)2和CuSO4 |
| D、KOH和CuCl2 Ba(OH)2和CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制盐酸溶液用量筒量取盐酸时俯视刻度线 |
| B、浓H2SO4稀释后未经冷却即注入容量瓶配制 |
| C、配制100mL1mol/L Na2CO3溶液时,砝码放在托盘天平左盘 |
| D、配制盐酸溶液定容时,仰视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室中,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g).测得在一定压强下的平衡转化率与温度的关系如图所示,下列说法错误的是( )
将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室中,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g).测得在一定压强下的平衡转化率与温度的关系如图所示,下列说法错误的是( )| A、该反应为吸热反应 |
| B、100℃时,该反应的平衡常数K=7.2×10-5 mol2?L-2 |
| C、为提高甲烷的转化率,可增加甲烷与水的投料比 |
| D、若100℃时达到平衡所需时间为5min,那么0~5min内υ(H2)=0.0024mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com