
【题目】常温下将0.04克氢氧化钠溶于水配制成100 mL溶液物质的量浓度为____mol/L; pH为______,要使它的pH降为11。(假设溶液混合体积等于稀释前两液体体积之和)若加入蒸馏水,应加________mL。若加入pH为10的NaOH溶液,应加______mL。若加入0.01 mol·L-1的盐酸,应加________mL(保留三位有效数字)。
【答案】0.01mol/l 12 900 1000 81.8
【解析】
试题分析:0.04克氢氧化钠的物质的量为![]() =0.001mol,溶于水配制成100 mL溶液物质的量浓度为
=0.001mol,溶于水配制成100 mL溶液物质的量浓度为![]() =0.01mol/L,pH=-lgc(H+)=-lg
=0.01mol/L,pH=-lgc(H+)=-lg![]() =-lg
=-lg![]() =12;
=12;
设加入蒸馏水的体积为x,pH=11,则c(OH-)=1×10-3mol/L,c(OH-)=![]() =1×10-3mol/L,解得x=0.9L=900mL,
=1×10-3mol/L,解得x=0.9L=900mL,
设加入pH为10的NaOH溶液的体积为y,c(OH-)=![]() =1×10-3mol/L,解得:y=1L=1000mL,
=1×10-3mol/L,解得:y=1L=1000mL,
设加入0.01 mol·L-1的盐酸的体积为z,c(OH-)=![]() =1×10-3mol/L,解得:z=0.0818L=81.8mL。
=1×10-3mol/L,解得:z=0.0818L=81.8mL。


科目:高中化学 来源: 题型:
【题目】按要求完成下列填空。
(1)同温同压下烷烃A蒸气的密度是H2的15倍,烷烃A的分子式:______________;结构简式 。
(2)烷烃B的分子中含有200个氢原子,烷烃B的分子式:________。
(3)含有5个碳原子的烷烃D,烷烃D的分子式: ___________。
(4)分子中含有22个共价键的烷烃,烷烃的分子式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是_______________(填两种物质的名称),其净水作用的原理是_______________________。
(2)水的净化与软化的区别是______________________________________。
(3)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol·L-1,c(Mg2+)=6×10-4mol·L-1,则此水的硬度为________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2_______g,后加入Na2CO3_______g。
(5)如图是电渗析法淡化海水的原理图,其中电极A接直流电源的正极,电极B接直流电源的负极。
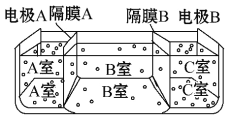
①隔膜A是________(填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl-以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月5日,从瑞典斯德哥尔摩传来令人振奋的消息:中国女科学家屠呦呦获得2015年诺贝尔生理学或医学奖。理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。青蒿素的一种化学合成部分工艺流程如下:

已知:羰基![]() H可发生反应应
H可发生反应应![]()
回答下列问题:
(1)青蒿素的含氧官能团名称: 和过氧基;
(2)写出A发生加聚反应的化学方程式 ;
(3)反应B→C,实际上可看作两步进行,依次发生的反应类型是 ;
(4)写出由苯甲醛和氯乙烷为原料,制备苄基乙醛(![]() CH2CH2CHO)的合成路线流程图;无机试剂任用,合成路线流程图示例如下:CH3CH2OH
CH2CH2CHO)的合成路线流程图;无机试剂任用,合成路线流程图示例如下:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() H2C Br-CH2 Br
H2C Br-CH2 Br
。
(5)写出E发生水解反应的化学方程式 。
(6)写出HC(OCH3)3只属于醇的同分异构体的结构简式(同一个碳原子上不能同时连接两个羟基) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物(如Na2Sn)。回答下列问题:
Ⅰ.在浓Na2S溶液中滴入少量氯水,经振荡,未发现沉淀物生成,其原因是(用离子方程式表示)___________________________________________________。
Ⅱ.浓硫酸具有氧化性,不同浓度的硫酸氧化性不同。为了探究浓度对硫酸氧化性的影响,某学习小组进行了如下探究:称取一定量无锈铁钉(碳素钢)放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。为了测定气体Y中SO2的含量,设计如下三种方案:
方案①:取V mL(标准状况)气体Y通入足量氯水中,然后加入足量BaCl2溶液,经“适当操作”后得干燥固体m g。
方案②:向200.0 mL 0.200 mol/L酸性高锰酸钾溶液中缓慢通入2.24 L(标准状况)气体Y,之后取出20.00 ml溶液转入锥形瓶中加适量水稀释,用浓度为0.100 mol/L的KHC2O4标准液进行滴定,最终消耗标准液10.00ml。
(1)方案①中“适当操作”是指 (填操作名称);检验所得固体是否洗涤干净的操作为 ;
(2)已知室温下,0.1mol/L 的KHC2O4溶液中,c(C2O42- )>c(H2C2O4)。在方案②中,滴定操作过程中标准液应装在 (填仪器名称);滴定至终点的现象为 ;
(3)根据方案②计算气体Y中SO2的物质的量分数为 ;
Ⅲ.分析上述实验中SO2体积分数的结果,某同学认为气体Y中还可能含有少量的H2和CO2。为此设计了下列探究实验装置检验其中的杂质气体(夹持装置已略去)。
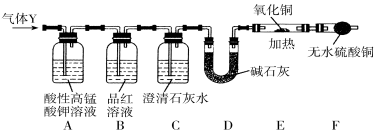
(1)仪器D的名称是 ;B中试剂的作用是 ;
(2)简述确认气体Y中含有CO2的实验现象:________________________________。
(3)根据“F干燥管中无水硫酸铜是否变蓝色”确认气体Y中是否有氢气,你认为是否合理?______(填“合理”或“不合理”),简述理由:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) ![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O ![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中,Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
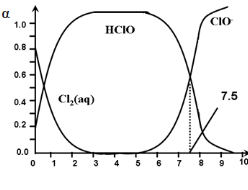
A.氯处理饮用水时,在夏季的杀菌效果比在冬季好
B.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
C.在氯处理水体系中,c(HClO) +c(ClO-) =c(H+)-c(OH-)
D.Cl2(g)+ H2O ![]() 2H+ + ClO- + Cl- ,K=10-12.1
2H+ + ClO- + Cl- ,K=10-12.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯,
已知: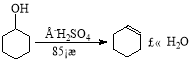
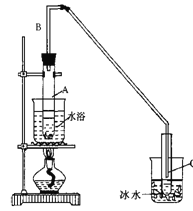
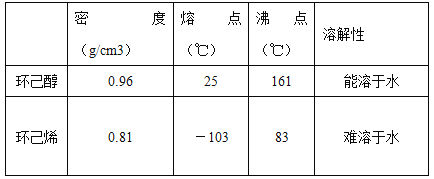
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是_______________________________________
(2)制备精品
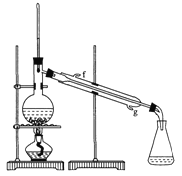
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下” ),分液后用______(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_______口进入。蒸馏时要加入生石灰,目的是________________________。
③收集产品时,控制的温度应在_________℃左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
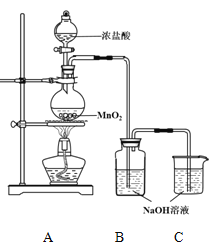
(1)写出装有浓盐酸的仪器名称 ,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是 。
(2)写出装置B中发生的所有反应化学方程式 。
(3)装置c的作用是 。反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
A.测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(4)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去,为探究操作A中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有漂白性。
(5)操作B中溶液变成黄绿色的原因: (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
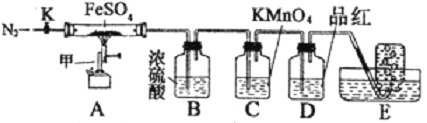
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取mgFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K。加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃。待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末。请回答下列问题:
(1)仪器甲的名称是__________;
(2)B中浓硫酸的作用__________。
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化。写出C中发生反应的离子方程式__________;
(4) FeSO4完全分解后,还需要通入一段时间N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
Ⅰ、称量B装置在实验前后增重 0.80g;
Ⅱ、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
Ⅲ、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mo1/L标准H2C2O4溶液滴定至终点:
Ⅳ、重复实验3次.记录数据如下:
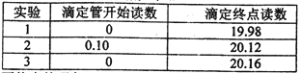
①滴定至终点的现象__________。
②FeSO4分解的化学方程式为__________。
(6)请设计一个实验来检验A中的FeSO4是否完全分解__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com