
| A、SO2能使溴水、酸性高锰酸钾溶液退色是因为SO2有漂白性 |
| B、若将SO2和Cl2以等物质的量混合后通入品红溶液中一定退色更快 |
| C、SO2通入Ba(OH)2溶液中,有白色沉淀生成,加入稀硝酸最终沉淀全部溶解 |
| D、SO2通入BaCl2溶液中无沉淀生成 |


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
| A | B | C | |
| D | E | F |
| A、D的单质是常见的半导体材料 |
| B、B与E形成的化合物不只一种 |
| C、C与F的原子序数之差一定为8 |
| D、C属于卤族元素,对应的单质能与水反应生成两种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
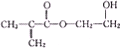 甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )
甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )| A、能发生加成反应 |
| B、能发生取代反应 |
| C、一定条件下,能与乙醇发生酯化反应 |
| D、既能是溴水褪色,又能使酸性高猛酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含0.1mol BaCl2的溶液中Cl-数为0.2NA |
| B、22g CO2所含有的分子数为0.5NA 已知M(CO2)=44g/mol |
| C、11.2L CO2所含有的分子数为0.5NA |
| D、常温下NA个N2分子电子数为14NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种元素的原子序数按Z、Y、X的顺序增大 |
| B、单质的氧化性按X、Y、Z的顺序减弱 |
| C、原子半径按X、Y、Z的顺序增大 |
| D、气态氢化物的稳定性按X、Y、Z的顺序增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ |
| C、①④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下,1L 0.1mol?L-1的NH4NO3溶液中NH
| ||
| B、常温下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA | ||
| C、标准状况下,2.24L乙烷中含有的非极性键数为0.7NA | ||
| D、1molCl2与足量的氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com