
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | 全部 |
分析 ①硫和变价金属反应时将变价金属氧化为较低价态,铜和硫反应生成硫化亚铜;
②铁和硫加热反应生成硫化亚铁;
③硫单质和氧气反应只能生成二氧化硫;
④硫单质和氢气反应生成硫化氢;
⑤铁和氯气反应只能生成氯化铁,铁和氯化铁溶液反应生成氯化亚铁.
解答 解:①硫和变价金属反应时将变价金属氧化为较低价态,铜和硫反应生成硫化亚铜,2Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,故①正确;
②铁和硫加热反应生成硫化亚铁,Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,故②错误;
③无论S是否过量,S在氧气中燃烧都生成SO2,所以能由单质直接化合生成,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故③正确;
④硫单质和氢气反应生成硫化氢,H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S,故④错误;
⑤铁和氯气反应生成氯化铁,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故⑤正确;
①③⑤不能由单质直接化合生成,
故选A.
点评 本题考查物质之间的反应,明确物质的性质是解本题关键,掌握物质性质和反应条件是解题关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 缩小体积使压强增大 | B. | 体积不变充入N2使压强增大 | ||
| C. | 体积不变充入He使气体压强增大 | D. | 总压强不变充入Ne |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 | |
| B. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
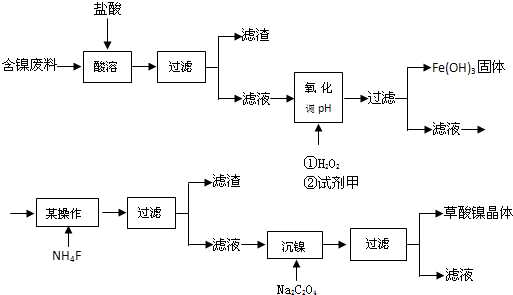
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的有机物,下列关于它的说法不正确的是( )
的有机物,下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 难溶于水,且密度比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+与S${\;}_{4}^{2-}$的物质的量浓度之比为2:3 | |
| B. | SO${\;}_{4}^{2-}$的物质的量为0.5mol | |
| C. | 1L溶液中含阴、阳离子共2.5NA个 | |
| D. | 从1L 0.5mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
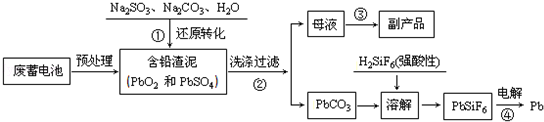
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com