
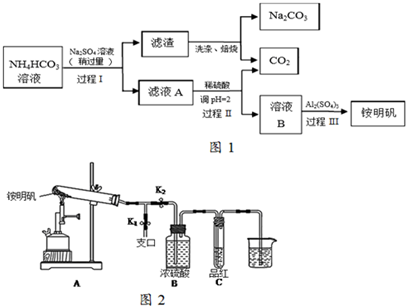
分析 碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾.
(1)铵明矾溶液中铝离子水解,溶液呈酸性,得到氢氧化铝胶体,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝;
(2)过程I利用溶解度不同发生复分解反应;
(3)HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀;
(4)用于铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥;
(5)①由题目信息可知有NH3生成,用蘸有浓盐酸的玻璃棒靠近支口检验氨气;装置A和导管中未见红棕色气体,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3;装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝;
②根据电子转移守恒确定n(N2):n(SO2),相同条件下气体体积之比等于其物质的量之比.
解答 解:(1)铵明矾溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性;水解得到氢氧化铝胶体,可以吸附悬浮物质,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝,现象为:先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失,
故答案为:酸性;铵明矾溶液电离出的铝离子水解生成氢氧化铝胶体,有吸附作用,故铵明矾能净水;先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失;
(2)过程I利用溶解度不同发生复分解反应,反应方程式为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,
故答案为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ;
(3)省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低,
故答案为:省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低;
(4)用于铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:冷却结晶;
(5)①检验氨气方法为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;装置A和导管中未见红棕色气体,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3,白色固体可能是(NH4)2SO3;装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝,与氢氧化钠溶液反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;(NH4)2SO3;Al2O3+2OH-=2AlO2-+H2O;
②根据电子转移守恒:2×[0-(-3)]×n(N2)=n(SO2)×(6-4),故n(N2):n(SO2)=1:3,相同条件下气体体积之比等于其物质的量之比,故V(N2):V(SO2)=1:3,
故答案为:1:3.
点评 本题考查制备实验方案设计、物质组成的测定,明确工艺流程原理是解题关键,综合考查学生分析解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入少量的NaCl固体,Ksp(AgCl)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 25℃时,当溶液中c(Ag+)×c(Cl-)=Ksp(AgCl)时,此溶液为AgCl的饱和溶液 | |
| D. | 将固体AgCl加入到浓KI溶液中,部分AgCl转化为AgI,故AgCl溶解度小于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
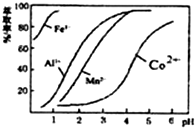
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.
已知酸性高锰酸钾溶液是常用的强氧化剂,可以和草酸钠、二氧化硫等还原性物质发生氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
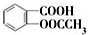 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下: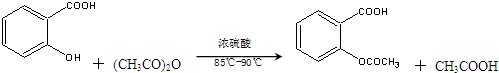
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未用待测溶液润洗 | |
| B. | 碱式滴定管未用待装溶液润洗 | |
| C. | 锥形瓶未用待装溶液润洗 | |
| D. | 在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com