
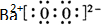 (写电子式).
(写电子式).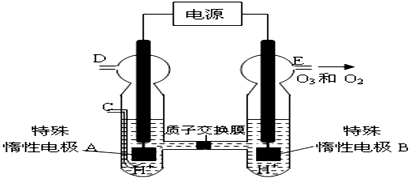
分析 (1)酸性条件下H2O2氧化KI生成碘单质和水;
(2)根据题目信息,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了沉淀;
(3)碳在氧气中燃烧,氧气不足发生反应2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,氧气足量发生反应C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;3.6g碳的物质的量为0.3mol,6.4g的氧气的物质的量为0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生;令生成的CO为xmol,CO2为ymol,根据碳元素与氧元素守恒列方程计算x、y的值,计算生成ymol二氧化碳的热量,放出的总热量减去生成二氧化碳放出的热量为生成xmolCO放出的热量,据此计算1molC与O2反应生成CO的反应热△H;
①反应中碘化钾是还原剂,臭氧作氧化剂得电子发生还原反应,反应中得电子化合价降低的物质是氧化剂,氧化剂对应的产物是还原产物;
②依据元素化合价变化结合电子守恒配平书写化学方程式;
(4)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极;
②若C处不通入O2,实质为电解水,D处为氢气,体积为11.2L,E处为氧气、臭氧,体积共为4.48L,令臭氧的体积为xL,利用电子转移守恒列放出计算x的值,再根据体积分数定义计算;
③C处通入O2,O2发生还原反应,在酸性条件下生成水.
解答 解:(1)酸性条件下H2O2氧化KI生成碘单质和水,反应的离子方程式为:H2O2+2I-+2H+═I2+2H2O;
故答案为:H2O2+2I-+2H+═I2+2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,过氧化钡是离子化合物,电子式为: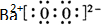 故答案为:
故答案为: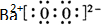 ;
;
(3)碳在氧气中燃烧,氧气不足发生反应2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,氧气足量发生反应C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
3.6g碳的物质的量为$\frac{3.6g}{12g/mol}$=0.3mol,6.4g的氧气的物质的量为$\frac{6.4g}{32g/mol}$=0.2mol,n(C):n(O2)=3:2,
介于2:1与1:1之间,所以上述反应都发生.令生成的CO为xmol,CO2为ymol,
根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1.
12.0g碳完全燃烧,放出热量为b kJ,所以生成0.1mol二氧化碳放出的热量为0.1mol×bkJ/mol=0.1bkJ,
所以生成0.2molCO放出的热量为akJ-0.1bkJ.由于碳燃烧为放热反应,所以反应热△H的符号为“-”,
故C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=w,w=-$\frac{akJ-0.1bkJ}{0.2mol}$=-(5a-0.5b)kJ/mol,
该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物,碘元素化合价-1价变化为0价,氧元素化合价变化为-2价,结合电子守恒配平书写化学方程式为:2KI+O3+H2O=2KOH+I2+O2;
故答案为:-(5a-0.5b);①KOH;②2KI+O3+H2O=2KOH+I2+O2;
(4)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑,故答案为:A;
②若C处不通入O2,实质为电解水,D处为氢气,体积为11.2 L,物质的量为0.5mol,E处为氧气、臭氧,体积共为4.48L,物质的量为0.2mol;
令臭氧的体积为xL,根据电子转移守恒有
0.5×2=x×3×2+(0.2-x)×2×2,解得Z=0.5mol-2×0.2mol=0.1,所以E处收集的气体中O3所占的体积分数为$\frac{0.1mol}{0.2mol}$×100%=50%,
故答案为:50%;
③C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
点评 本题考查原电池与电解池反应原理、反应热的计算、氧化还原反应计算、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | 向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | 向明矾[KAl(SO4)2•12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 直径介于1-100nm之间的微粒称为胶体 | |
| C. | 胶体粒子很小,可以透过半透膜 | |
| D. | 鸡蛋清和豆浆都属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红的溶液中:Ag(NH3)2+、Fe3+、Cl-、NO3- | |
| B. | 常温下c(H+)=10-14mol/L的溶液中:Na+、AlO2-、SO32-、S2- | |
| C. | “84”消毒液中:NO3-、Cl-、Ca2+、H+ | |
| D. | 常温时,在中性溶液中:Na+、Fe3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Ca(OH)2 | C. | H2SO4 | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2-1s22s22p4 | B. | Ca 3d2 | ||
| C. | Fe 3d54s3 | D. | Si 1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
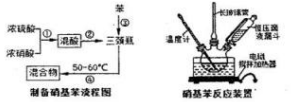
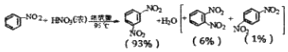
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com