
【题目】下列有关物质的性质与应用相对应的是( )
A. BaCO3能与盐酸反应,可用于治疗胃酸过多
B. MgO熔点高,可用作耐高温材料
C. SO2具有氧化性,可用于漂白品红、织物等
D. NH3极易溶于水,可用作制冷剂
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)在3个阶段中,N2的平均反应速率![]() (N2)、
(N2)、![]() (N2)、
(N2)、![]() (N2)中最大的是 ,其值是 。
(N2)中最大的是 ,其值是 。
(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(3)由第一次平衡到第二次平衡,平衡移动的方向是 (填“正反应方向”或“逆反应方向”),采取的措施是 。
(4)第Ⅰ阶段时,化学平衡常数K1= ;第Ⅱ、Ⅲ阶段化学平衡常数K2 K3;(填“>、<、=”)判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。已知:① 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5;
② Na2S2O5晶体在空气中被氧化生成Na2SO4。
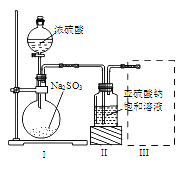
(1) 装置Ⅰ中产生气体的化学方程式为:_____________________________。
(2) 要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
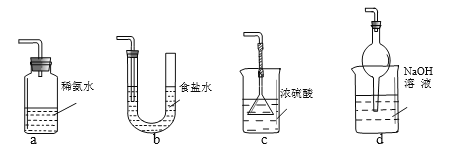
(3) 装置Ⅲ用于处理尾气,可选用右图中最合理装置(夹持仪器已略去)为___________(填序号)。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是: 。
(5)为了研究Cl2与SO2的在干燥条件下发生反应及进行的程度。用右下图所示装置收集满干燥的Cl2,再通入干燥的SO2,集气瓶中立即出现无色液体SO2Cl2; 充分反应后,将液体和剩余气体分离。用除尽空气的NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 ,由此可知反应后剩余的气体为Cl2和 ,综合实验信息,干燥的SO2与Cl2反应的化学方程式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等量的苛性钠溶液分别用pH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb,则它们之间的关系是
A. Va>10Vb B. Vb=10Va C. Va<10Vb D. Vb>10Va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法,错误的是( )
A. 乙酸乙酯在一定条件下可以水解成乙醇和乙酸
B. 油脂和蔗糖都属于高分子化合物
C. 油脂水解能得到甘油
D. 淀粉、纤维素在一定条件下水解均可得到葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g) ![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
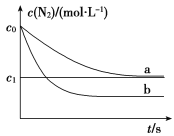
A.温度T下,该反应的平衡常数K=![]()
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
A. Na+、Ba2+、Cl-、SO42-
B. Ca2+、HCO3-、C1-、K+
C. MnO4-、K+、I-、H+
D. H+、Cl-、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的可逆反应:4L(g)![]() 2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指

A. 气体混合物的平均相对分子质量 B. 气体混合物的总物质的量浓度
C. L在气体混合物的体积分数 D. 气体混合物的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的离子,能在溶液中大量共存的是
A. K+、H+、SO42-、OH- B. Na+、 Ca2+、 CO32-、NO3-
C. Na+、H+、Cl-、CO32- D. Na+、 Cu2+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com