
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| y |
| 2 |
| x |
| 2 |
| y |
| 2 |
| x |
| 2 |
| y |
| 2 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| A、Na+、SiO32-、NO3-、CO32- |
| B、K+、Cl-、MnO4-、SO42- |
| C、Na+、NO3-、SO42-、HCO3- |
| D、Na+、SO42-、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
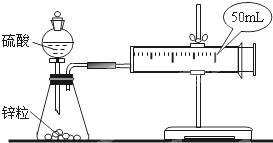 两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.查看答案和解析>>
科目:高中化学 来源: 题型:
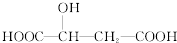 )说法正确的是( )
)说法正确的是( )| A、苹果酸不易溶于水而易溶于有机溶剂 |
| B、和苹果酸具有相同官能团的同分异构体只有1种 |
| C、1 mol苹果酸与足量NaOH溶液反应时,最多消耗3 mol NaOH |
| D、1mol苹果酸与足量NaHCO3溶液反应时,最多可得44.8LCO2(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体、溶液、浊液都是分散系 |
| B、粒子的半径:浊液>溶液>胶体 |
| C、可见光通过溶液时,产生丁达尔现象 |
| D、胶体都不透明,且稳定性极强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com