
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 葡萄糖可以制乙醇,两者都能与金属钠反应 | |
| C. | 明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视 | |
| D. | 合成纤维和光导纤维都是有机高分子化合物 |
分析 A.根据煤的气化和液化的概念分析;
B.羟基能与钠反应;
C.明矾水解可以产生胶状的Al(OH)3;碳酸钡能够溶于胃酸,不能用于钡餐;
D.光导纤维为二氧化硅.
解答 解:A.煤的气化是煤与水蒸汽反应H2、CO等气体的过程.煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,两种过程都生成了新物质,是化学变化,故A错误;
B.羟基能与钠反应,葡萄糖和乙醇都含有羟基,故B正确;
C.明矾水解可以产生胶状的Al(OH)3,具有吸附作用可用于净化水;硫酸钡用作钡餐,碳酸钡能够溶于胃酸,不能用于钡餐,故C错误;
D.光导纤维为二氧化硅,属于无机非金属材料,而合成纤维是有机高分子化合物,故D错误,
故选B.
点评 本题考查了物质的性质和用途,为常考查点,难度不大,注意硫酸钡用作钡餐,碳酸钡能够溶于胃酸,不能用于钡餐.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
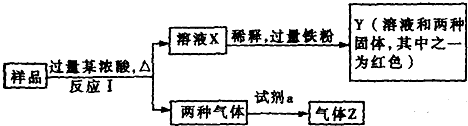
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由元素的原子序数推测其在元素周期表中的位置 | |
| B. | 由H-H和Cl-Cl的键长推测液氢和液氯沸点的高低 | |
| C. | 由CaF2晶体中,与Ca2+距离最近的F-有8个,推知与F-距离最近的Ca2+也有8个 | |
| D. | 由N≡N、H-H、N-H的键能数据估算3H2(g)+N2(g)?2NH3(g)的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | R在周期表的第15列 | |
| B. | Y、Q两种元素的气态氢化物的热稳定性:HQ>HY | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理 | |
| B. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| C. | 地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况) | 50 | 120 | 232 | 290 | 310 |
| A. | 在0~1,1~2,2~3,3~4,4~5min时间段中,反应速率最大的时间是4~5段,因为在此段时间内生成气体最多 | |
| B. | 在2~3min时间段内,用盐酸浓度变化表示的反应速率为0.1mol•L-1min-1 | |
| C. | 在该稀盐酸中分别加入等体积的蒸馏水、Na2SO4溶液或Na2CO3溶液都能减缓反应速率且不减少产生氢气的量 | |
| D. | 为了加快该化学反应速率,可以向其中加入MgSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com