
| A. | 标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 | |
| B. | 1L 0.1 mol•L-1的Na2SO4溶液中含有0.2 nA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为nA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nAFe3+ |
分析 A.氯化氢为强电解质,在溶液中不存在氯化氢分子;
B.根据n=cV计算出溶质硫酸钠的物质的量,再计算出含有的钠离子数目;
C.1mol氯酸钾中含有1mol硫酸根离子,含有2mol负电荷;
D.铁离子在溶液中部分水解,导致铁离子数目减少.
解答 解:A.氯化氢属于强电解质,在溶液中完全电离,不存在氯化氢分子,故A错误;
B.1L 0.1 mol•L-1的Na2SO4溶液中含有0.1mol硫酸钠,含有0.2mol钠离子,含有0.2 nA个Na+,故B正确;
C.1 mol 硫酸钾中含有1mol硫酸根离子,阴离子所带电荷为2mol,电荷数为2nA,故C错误;
D.铁离子在溶液中发生水解,则溶液中含有的铁离子小于0.1mol,溶液中含有的铁离子数目小于0.1nA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的转化关系,A为易错点,注意氯化氢为强电解质,溶液中不存在溶质分子.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:填空题
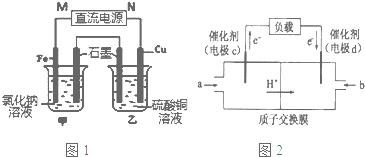
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
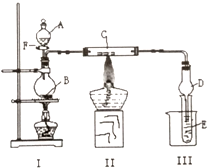 用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.
用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
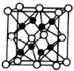 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+]=[OH-]的溶液 | B. | pH<7的溶液 | ||
| C. | [H+]=1.0×10-7mol•L-1 的溶液 | D. | [H+]>[OH-]的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10gD2O中含有的电子数为5NA | |
| B. | 1molC3H8分子中共价键总数为10NA | |
| C. | 92gNO2和N2O4混合气体中含有原子数为3NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g D2O中含有的电子数为5 NA | |
| B. | 1mol C3H8分子中共价键总数为10 NA | |
| C. | 92g NO2和N2O4混合气体中含有原子数为3 NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于20 mL | B. | 小于20 mL | C. | 等于20mL | D. | 等于5mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com