
| ||
| ||
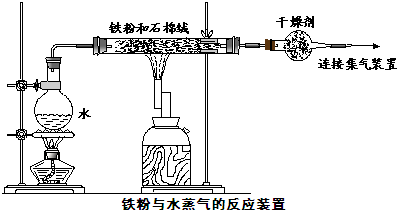
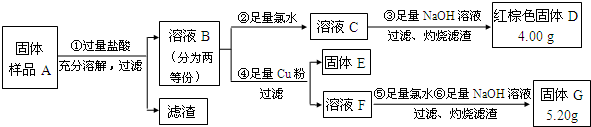
| ||
| ||
| 0.448L |
| 22.4L/mol |
| ||
| 3 |
| 4 |
| 3 |
| 4 |
| 4.0g |
| 160g/mol |
| 1.2g |
| 80g/mol |


科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
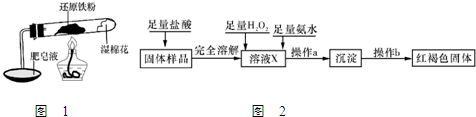
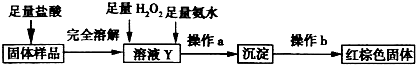
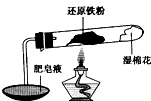 在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
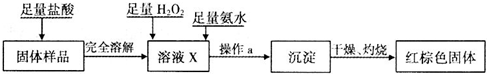
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入适量盐酸,微热 | 黑色粉末全部溶解,溶液呈 浅绿色 浅绿色 ,有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液加几滴KSCN溶液,振荡 | 溶液不显血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
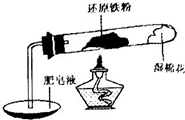 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com