
| A. | B、C、D 形成的简单离子半径依次增大 | |
| B. | B、C 形成的化合物只含有离子键 | |
| C. | A、C、D 形成的化合物CDA4,属于离子化合物,有较强的还原性 | |
| D. | A、B、C 形成的化合物与B、C、D 形成的化合物可以发生化学反应 |
分析 A、B、C、D是短周期中原子序数依次增大的4种主族元素,其中A元素的一种核素形成的单质是核聚变的理想材料元素,则A是H,B元素原子最外层电子数是电子层数的3倍,则B是O,C在同周期的主族元素中原子半径最大,按原子序数依次递增,同一周期原子半径从左到右逐渐减小,C应是第三周期元素,则C为Na元素,元素D是地壳中含量最多的金属元素,则D为Al元素,以此解答该题.
解答 解:根据分析得出:A、B、C、D分别是H、O、Na、Al,
A.B、C、D 形成的简单离子分别是O2-、Na+、Al3+,电子层结构相同,原子序数小半径反而大,则B、C、D 形成的简单离子半径依次减小,故A错误;
B.B、C 形成的化合物有氧化钠、过氧化钠,氧化钠中只含有离子键,过氧化钠中既有离子键又有非极性共价键,故B错误;
C.A、C、D 形成的化合物是NaAlH4,CDA4属于离子化合物,其中氢为-1价,有较强的还原性,故C正确;
D.A、B、C 形成的化合物是氢氧化钠,B、C、D 形成的化合物是偏铝酸钠,二者不可以发生化学反应,故D错误;
故选:C.
点评 本题主要考查的原子结构与元素周期律的应用,为高频考点,题目考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力,难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 | |
| C. | 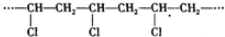 的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 等质量的CH4、C2H4、C4H6分别在空气中充分燃烧,所耗用氧气的量依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (一氯环己烷)$→_{②}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{②}^{NaOH,乙醇,△}$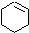 $→_{③}^{Br_{2}的CCl溶液}$
$→_{③}^{Br_{2}的CCl溶液}$ $\stackrel{④}{→}$
$\stackrel{④}{→}$ ,名称是环己烷
,名称是环己烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生气体的快慢,来反映试剂反应速率的大小.从而探究浓度温度等外界条件对该反应的化学反应速率的影响 | |
| B. | 容量瓶、滴定管上都标有使用温度和“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 | |
| C. | 油脂皂化反应后的反应液中加入饱和食盐水并搅拌后出现分层,则生成的高级脂肪酸钠在下层 | |
| D. | 只用 NaHCO3 溶液就可鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 12 | C. | 16 | D. | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可将稀硫酸改成浓硫酸 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,氢气转化率增大 | |
| D. | 反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com