
【题目】下列叙述中正确的是( )
A. 能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸
B. 无机含氧酸分子中含有几个羟基,它就属于几元酸
C. 同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D. H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
【答案】D
【解析】
无机含氧酸分子中有几个羟基-OH,就是几元酸,不光是看H原子个数;硼酸H3BO3![]() 结构式B(OH)3
结构式B(OH)3![]()
![]()
![]() 元酸;含氧酸中,中心原子的化合价高,其氧化性不一定强;二氧化碳的溶解度较小,溶于水的二氧化碳分子只有极少数与水结合成碳酸,所以碳酸酸性较弱。
元酸;含氧酸中,中心原子的化合价高,其氧化性不一定强;二氧化碳的溶解度较小,溶于水的二氧化碳分子只有极少数与水结合成碳酸,所以碳酸酸性较弱。
无机含氧酸分子中有几个羟基-OH,就是几元酸,不光是看H原子个数,如H3PO3,结构为 HPO(OH)2,是二元酸,故A错误;硼酸H3BO3![]() 结构式B(OH)3
结构式B(OH)3![]() 但是电离实际发
但是电离实际发![]()
![]() 是一元酸,故B错误;同一元素的不同含氧酸中,该元素的化合价越高,其含氧酸的酸性越强,但氧化性不一定强,如HClO的酸性很弱,但氧化性很强,故C错误;H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸的原因是二氧化碳的溶解度较小,溶于水的二氧化碳分子只有极少数与水结合成碳酸,故D正确。
是一元酸,故B错误;同一元素的不同含氧酸中,该元素的化合价越高,其含氧酸的酸性越强,但氧化性不一定强,如HClO的酸性很弱,但氧化性很强,故C错误;H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸的原因是二氧化碳的溶解度较小,溶于水的二氧化碳分子只有极少数与水结合成碳酸,故D正确。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】已知2KClO3 + H2C2O4 + H2SO4= K2SO4 + 2ClO2 + 2CO2 + 2H2O。
(1)用单线桥法表示该反应的电子转移的方向和数目_______。
(2)该反应的氧化剂是____,还原剂是_____,氧化产物是_____,还原产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:
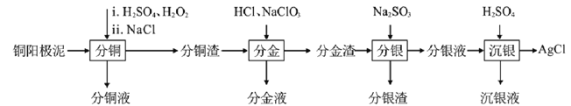
已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。
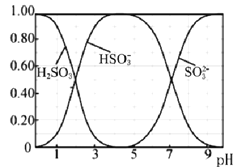
“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
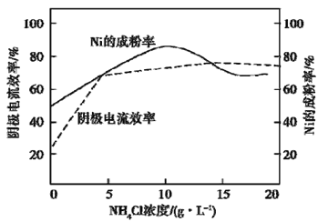
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
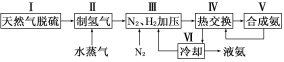
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________。
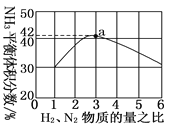
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
D. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2 与SO2 以体积比1:2 置于恒容密闭容器中发生反应: ![]() 。下列能说明该反应达到平衡状态的是
。下列能说明该反应达到平衡状态的是
A. v(SO3 ) = v(NO2 ) B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变 D. 每消耗1 mol SO3 的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化合物、氢氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。工业上处理氮的氧化物途径有多种:
I.氨吸法。
(1)已知:①![]()
![]()
②![]()
![]()
则用![]() 处理
处理![]() 生成氮气和气态水的热化学方程式为____________________。
生成氮气和气态水的热化学方程式为____________________。
Ⅱ.催化氧化法:城市中![]() 和
和![]() 污染主要来源于汽车尾气,可以利用化学方法将其转化为无害的物质如:
污染主要来源于汽车尾气,可以利用化学方法将其转化为无害的物质如:![]() 。
。
(2)为研究汽车尾气转化为无毒无害的物质有关反应,在密闭容器中充入![]() 和
和![]() ,发生反应,如图为平衡时
,发生反应,如图为平衡时![]() 的体积分数与温度、压强的关系。
的体积分数与温度、压强的关系。

①该反应达到平衡后,为在提高反应速率同时提高![]() 的转化率,可采取的措施有_____________(填字母序号)
的转化率,可采取的措施有_____________(填字母序号)
a.改用高效催化剂b.缩小容器的体积c.升高温度d.增加![]() 的浓度
的浓度
②压强为![]() 、温度为
、温度为![]() 下,若反应进行到
下,若反应进行到![]() 达到平衡状态,容器的体积为
达到平衡状态,容器的体积为![]() ,用
,用![]() 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率![]() ________,该温度下平衡常数
________,该温度下平衡常数![]() ______(用平衡分压代替平衡浓度计算,分压=总压
______(用平衡分压代替平衡浓度计算,分压=总压![]() 物质的量分数;保留两位有效数字)。
物质的量分数;保留两位有效数字)。
③若在![]() 点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中
点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中![]() 点中的_____点
点中的_____点
Ⅲ.电解硝酸工业的尾气![]() 可制备
可制备![]() ,其工作原理如图
,其工作原理如图

(3)![]() 极的电极反应式为_________________。
极的电极反应式为_________________。
(4) 在![]() 时,将
时,将![]() 氨水与
氨水与![]() 的硝酸等体积混合后溶液显中性,用含
的硝酸等体积混合后溶液显中性,用含![]() 的代数式表示
的代数式表示![]() 的水解常数
的水解常数![]() _______
_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】民间艺术是劳动人民智慧的结晶,下列中国传统民间艺术在表演过程中涉及化学变化的是
A | B | C | D |
刺绣 | 打树花 | 剪纸 | 织锦 |
|
|
|
|
用针线在织物上 绣制图案 | 将熔化的铁水泼向 空中,迸溅出火花 | 用剪刀或刻刀在纸上剪刻花纹 | 用提花机织出图案 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com