
| A. | NaOH和稀H2SO4:OH-+H+═H2O | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | 碳酸钠溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | NaHCO3和H2SO4反应:HCO3-+H+═H2O+CO2↑ |
分析 A.NaOH和稀H2SO4反应的实质是氢离子与氢氧根离子反应生成水;
B.漏掉氢氧根离子与碳酸根离子的反应;
C.碳酸钠与二氧化碳、水反应生成碳酸氢钠;
D.NaHCO3和H2SO4反应生成硫酸钠和水、二氧化碳.
解答 解:A.NaOH和稀H2SO4,离子方程式:OH-+H+═H2O,故A正确;
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++HCO3-+2OH-═NH3↑+2H2O+CO32-,故B错误;
C.碳酸钠与二氧化碳、水反应生成碳酸氢钠,离子方程式:CO32-+CO2+H2O═2HCO3-,故C正确;
D.NaHCO3和H2SO4反应,离子方程式:HCO3-+H+═H2O+CO2↑,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项B为易错选项.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH- | B. | SO${\;}_{4}^{2-}$ | C. | Ba2+ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 约5mL | B. | 约10mL | C. | 约30mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
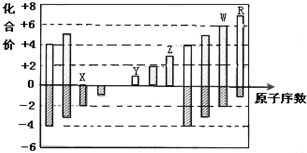
| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | 最高价氧化物的水化物的碱性:Y<Z | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸胶体:OH-、K+、S2-、Na+ | B. | 空气:C2H4、CO、SO2、NO | ||
| C. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | D. | 高锰酸钾溶液:H+、Na+、SO42-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
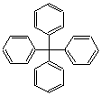
| A. | 此物质属于芳香烃 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 此分子的一氯取代产物有12种 | D. | 此物质分子式为C25H20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com