
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z可形成Z2、Z3两种气态单质 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为56,中子数为30 |
| amol×1+bmol×3 |
| 2 |
| a+3b |
| 2 |
| a+3b |
| 2 |
| 16g |
| 3mol×32g/mol |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| 3 |
| 2 |
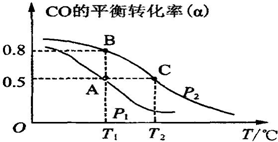
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2SO2+O2
| ||||
| B、SO2+2H2S═3S↓+2H2O | ||||
| C、SO2+NaOH═NaHSO3 | ||||
| D、SO2+Cl2+H2O═H2SO4+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| X | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无现象 |
| 稀硝酸 | 沉淀不消失 | 沉淀消失 有气体产生 | 沉淀不消失 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com