
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
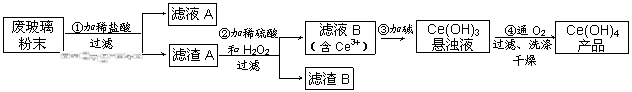 |
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗涤的方法是
 。
。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定终点是(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为 。
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.FeCl3溶液中加入过量的锌粉:Zn +2Fe3+=Zn2++2Fe2+
B.NH4Al(SO4)2中加入过量的NaOH溶液:Al3++4OH-=AlO2-+2H2O
C.(CH3COO)2Ba中加入稀硫酸:Ba2+ + SO42- = BaSO4↓
D.用惰性电极电解Cu(NO3)2溶液:2Cu2+ +2H2O  2Cu+ O2↑+ 4H+
2Cu+ O2↑+ 4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究铜与浓硫酸的反应,用如图所示装置进行有关实验。实验中甲同学将a g铜片和12 mL 8 mol·L-1浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。

请回答下列问题:
(1)请写出Cu与浓H2SO4反应的化学方程式:____________。
(2)装置D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是______________________________________________。
实验装置D有可能造成环境污染,试用最简单的方法加以解决(实验用品自选)__________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B装置中的现象是____________________________________。
(4)F中应放置的液体是________(填序号)。
A.饱和Na2SO3溶液
B.酸性KMnO4溶液
C.浓溴水
D.饱和NaHSO3溶液
(5)为什么有一定量的余酸,但未能使Cu完全溶解,你认为原因是_____________________________________________________。
(6)下列足量药品能够用来证明反应结束后的烧瓶中确有余酸的是________(填序号)。
A.铁粉 B.BaCl2溶液
C.Ag D.Na2CO3溶液
(7)甲同学向A中反应后的溶液中通入一种气 体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是________(填名称),反应方程式是_____________________________________________。
体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是________(填名称),反应方程式是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有适 用范围,下列根据有关“规律”推出的结论正确的是
用范围,下列根据有关“规律”推出的结论正确的是
| 选项 | 规律 | 结论 |
| A | 较强 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施不合理的是
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
27.Cl2氧化Br-应在 条件下进行,目的是为了避免
28.Br2可用热空气吹出,其原因是
29.写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为
30.为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是( )。
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以与NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请将下列物质能够发生的反应填写在下表中。
①由乙烯制氯乙烷
②乙烷与氯气光照
③乙烯使溴的四氯化碳溶液退色
④乙烯通入酸性高锰酸钾溶液
⑤乙烷在空气中燃烧
⑥由苯制取硝基苯
| 反应类型 | 取代反应 | 加成反应 | 氧化反应 |
| 反应 |
(2)甲烷、乙烯、苯三种有机物中具有下列性质的是(填写结构简式)
①在加热的条件下能够与浓硫酸、浓硝酸混合溶液反应,不能使酸性高锰酸钾溶液退色的是________;
②见光能跟氯气反应,不能使酸性高锰酸钾溶液退色的是________;
③在催化剂作用下加氢生成乙烷,加水生成酒精的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com