
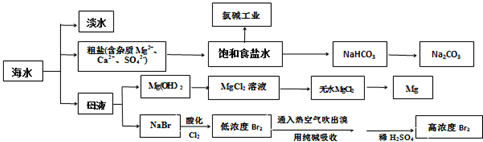
分析 (1)淡化海水,应降低水中的离子浓度,可用蒸馏法、离子交换法、电渗析法等;
(2)由题意可知电解氯化钠溶液生成次氯酸钠和氢气;
(3)检验沉淀是否洗涤干净,可检验最后一次的洗涤液是否含钡离子或氯离子;
(4)电解氯化镁阳极生成氯气,若生成两种气体,可能含有碳杂质,生成二氧化碳;
(5)用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,NaBr化合价降低1,生成NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒配平;
(6)纯溴为溴水中的有效溴和加入的溴化钠中的溴,根据溴原子守恒解答.
解答 解:(1)常见淡化海水的方法有蒸馏法、离子交换法、电渗析法等,
故答案为:蒸馏法;离子交换法;
(2)根据题意可知,氯气和氢氧化钠溶液反应生成物中只有一种溶质,所以该溶质是次氯酸钠,则反应的化学方程式是NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,
故答案为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(3)测定样品中NaCl的质量分数,由流程可知,固体bg为碳酸钡的质量,检验沉淀是否洗涤干净的方法为:取最后一次洗涤液少量于试管中,加入稀H2SO4(或硝酸酸化的AgNO3溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀出现,则沉淀已洗涤干净,
故答案为:取最后一次洗涤液少量于试管中,加入稀H2SO4(或硝酸酸化的AgNO3溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀出现,则沉淀已洗涤干净;
(4)电解熔融的MgCl2,氯离子移向阳极失电子生成氯气,镁离子在阴极得到电子生成镁,阳极的电极反应为;2Cl--2e-=Cl2↑;阴极电极反应是:Mg2++2e-=Mg,阳极上产生两种气体,可能的原因是原料中混有杂质C被氧化成二氧化碳,
故答案为:C;
(5)用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒得方程式为:3Br2+3Na2CO3═NaBrO3+5NaBr+3CO2↑,离子方程式为:3Br2+3CO32-═BrO3-+5Br-+3CO2↑,3molBr2参与反应,则转移5mol电子,吸收0.5molBr2时转移的电子为$\frac{5}{6}$mol,
故答案为:$\frac{5}{6}$;
(6)1m3这种海水体积为1000L,含n(Br-)=0.09mol/L×1000L,溴的损失率为30%;n(Br-)=0.09mol/L×1000L×(1-30%),加入10.3gNaBr物质的量为n=$\frac{m}{M}$=$\frac{10.3g}{103g/mol}$
所以m(Br2)=$\frac{1000L×0.09mol/L×(1-30%)+\frac{10.3g}{103g/mol}}{2}$,
故答案为:$\frac{1000L×0.09mol/L×(1-30%)+\frac{10.3g}{103g/mol}}{2}$.
点评 本题考查较综合,涉及海水资源利用、含量测定及计算、混合物分离提纯等,侧重分析、推断、计算能力的综合考查,为高考中常见的考查方式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 温度升高,c(HCO3-)减小 | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变小 | |
| C. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
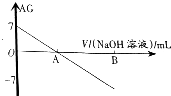 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-5 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(H+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中,这些离子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的过程中,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终不变 | |
| C. | 苯酚钠溶液中通入少量CO2,发生反应:2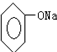 +H2O+CO2→2 +H2O+CO2→2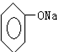 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亚铁溶液中滴入盐酸的离子反应方程式为:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量都为4.4g的CH3CHO和CO2含有的分子数均为0.1NA | |
| B. | 1molNa2O2中的离子总数为4NA | |
| C. | 密闭容器中,2molSO2和足量的O2反应转移的电子数为4NA | |
| D. | 1mol苯分子中所含的碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com