


科目:高中化学 来源: 题型:
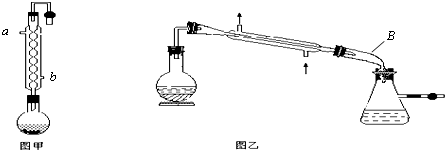
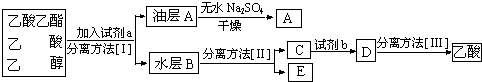
查看答案和解析>>
科目:高中化学 来源: 题型:
| 初始浓度(mol/L) | 平衡浓度(mol/L) | ||||
| c0(N2) | c0(H2) | c0(NH3) | c平(N2) | c平(H2) | c平(NH3) |
| 2.48 | 4.34 | 0 | 1.85 | 2.43 | 1.27 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.8 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
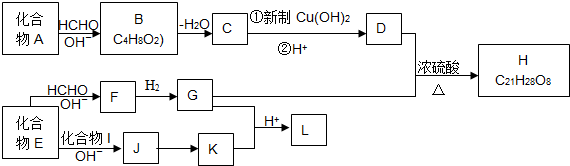
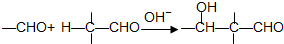
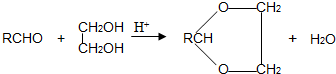
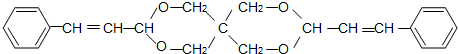
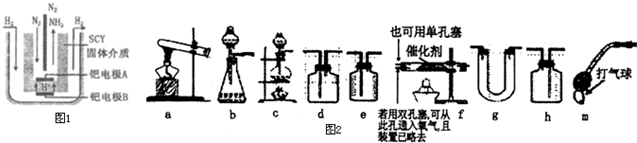
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
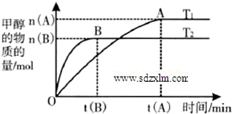 到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |
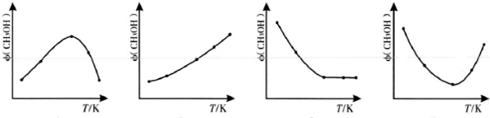
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
. |
| M |
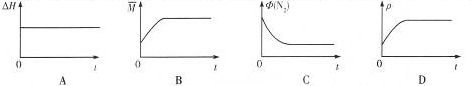
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
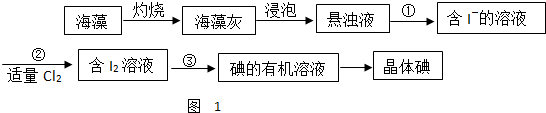
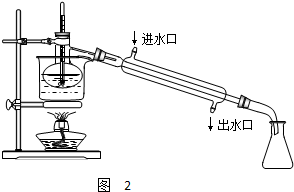
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com