
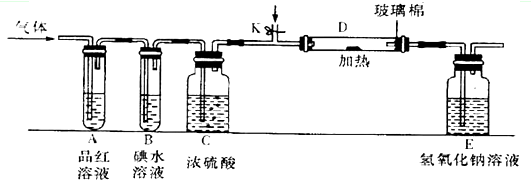
| 4 |
| 32 |
| 3 |
| 16 |
 ;
; ;
;| V2O5 |
| △ |
| V2O5 |
| △ |
| 4 |
| 32 |
| 3 |
| 16 |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4L酒精含有的分子数约为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、1NA氧原子的质量(以g为单位)在数值上约等于其相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、500 |
| B、600 |
| C、1 200 |
| D、1 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
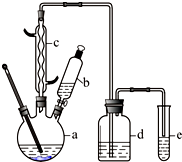 溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下:
溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
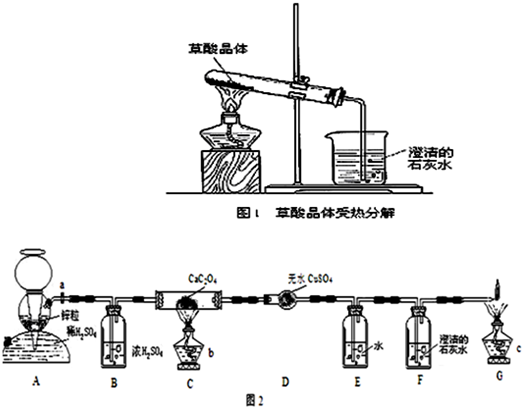
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com