
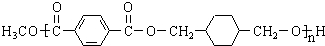 ,某研究小组用芳香烃A为原料合成PCT的合成路线如下.
,某研究小组用芳香烃A为原料合成PCT的合成路线如下.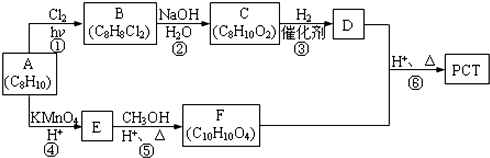
 ,A分子中最多有14个原子共平面.
,A分子中最多有14个原子共平面.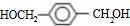 ,反应③的类型是加成反应,
,反应③的类型是加成反应,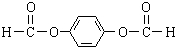 (写结构简式).
(写结构简式). 分析 A的不饱和度为$\frac{2×8+2-10}{2}$=4,由PCT的结构,结合A转化生成F及C,可知A中含有苯环,侧链为2个甲基处于对位,故A为 ,A与氯气在光照条件下发生甲基上的取代反应生成B,B在氢氧化钠水溶液发生取代反应生成C,由C的分子式、结合PTC的结构可知,A中每个甲基发生一元取代生成B,则B为
,A与氯气在光照条件下发生甲基上的取代反应生成B,B在氢氧化钠水溶液发生取代反应生成C,由C的分子式、结合PTC的结构可知,A中每个甲基发生一元取代生成B,则B为 ,B在氢氧化钠水溶液是发生取代反应生成C为
,B在氢氧化钠水溶液是发生取代反应生成C为 ,C与氢气发生加成反应生成F为
,C与氢气发生加成反应生成F为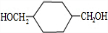 ,由PTC的结构可知,A→E是对二甲苯被酸性高锰酸钾氧化成E为
,由PTC的结构可知,A→E是对二甲苯被酸性高锰酸钾氧化成E为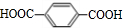 ,E→F是对苯二甲酸与甲醇酯化反应生成F为对
,E→F是对苯二甲酸与甲醇酯化反应生成F为对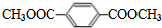 ,
, 和
和 交换后缩聚成PTC与甲醇.
交换后缩聚成PTC与甲醇.
解答 解:A的不饱和度为$\frac{2×8+2-10}{2}$=4,由PCT的结构,结合A转化生成F及C,可知A中含有苯环,侧链为2个甲基处于对位,故A为 ,A与氯气在光照条件下发生甲基上的取代反应生成B,B在氢氧化钠水溶液发生取代反应生成C,由C的分子式、结合PTC的结构可知,A中每个甲基发生一元取代生成B,则B为
,A与氯气在光照条件下发生甲基上的取代反应生成B,B在氢氧化钠水溶液发生取代反应生成C,由C的分子式、结合PTC的结构可知,A中每个甲基发生一元取代生成B,则B为 ,B在氢氧化钠水溶液是发生取代反应生成C为
,B在氢氧化钠水溶液是发生取代反应生成C为 ,C与氢气发生加成反应生成F为
,C与氢气发生加成反应生成F为 ,由PTC的结构可知,A→E是对二甲苯被酸性高锰酸钾氧化成E为
,由PTC的结构可知,A→E是对二甲苯被酸性高锰酸钾氧化成E为 ,E→F是对苯二甲酸与甲醇酯化反应生成F为对
,E→F是对苯二甲酸与甲醇酯化反应生成F为对 ,
, 和
和 交换后缩聚成PTC与甲醇.
交换后缩聚成PTC与甲醇.
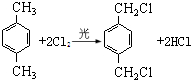
(1)A为 ,A的名称是:对二甲苯,反应①的化学方程式为:
,A的名称是:对二甲苯,反应①的化学方程式为: ,旋转碳碳单键可以使甲基中1个H原子处于苯环平面内,A分子中最多有 14个原子共平面,
,旋转碳碳单键可以使甲基中1个H原子处于苯环平面内,A分子中最多有 14个原子共平面,
故答案为:对二甲苯; ;14;
;14;
(2)C的结构简式是 ,反应③的类型是加成反应,
,反应③的类型是加成反应,
故答案为: ;加成反应;
;加成反应;
(3)E为 ,E含有的官能团是羧基,反应⑥除了生成PCT外,还生成了一种可以循环利用的有机物,该有机物是CH3OH,
,E含有的官能团是羧基,反应⑥除了生成PCT外,还生成了一种可以循环利用的有机物,该有机物是CH3OH,
故答案为:羧基;CH3OH;
(4)C为 ,C的同分异构体中属于苯的二元取代物且能与FeCl3溶液发生显色反应,含有酚羟基,另外取代基为-CH2CH2OH,或者为-CH(CH3)OH,或者为-OCH2CH3,或者-CH2OCH3,各有邻、间、对3种,故共有12种,
,C的同分异构体中属于苯的二元取代物且能与FeCl3溶液发生显色反应,含有酚羟基,另外取代基为-CH2CH2OH,或者为-CH(CH3)OH,或者为-OCH2CH3,或者-CH2OCH3,各有邻、间、对3种,故共有12种,
E的同分异构体中,能发生水解反应,说明含有酯基,且苯环上一氯代产物只有一种,含有2个相同的酯基且处于对位,该同分异构体的结构简式是: ,
,
故答案为:12; .
.
点评 本题考查有机物的推断与合成,清楚生成PCT的反应是解决此题的关键,它是醇和酯交换后缩聚而成,注意分析PTC的结构,结合反应条件判断其它物质,熟练掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:Y>X | |
| B. | 氢化物的稳定性:Z>W | |
| C. | X与Z形成的化合物溶于水所得溶液显碱性 | |
| D. | Y与W形成的化合物溶于水所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1 mol•L-1Na2CO3溶液中含有0.1NACO32- | |
| B. | 4.2gN3-中含有的电子数为2.4NA | |
| C. | 6.4gCu与足量浓硝酸反应,一定转移0.2 NA个电子 | |
| D. | 常温常压下,22.4L H2O中共用电子对数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中可能含钠元素 |
| B | 向某无色溶液中通人过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加少量MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度小于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
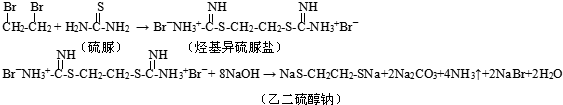
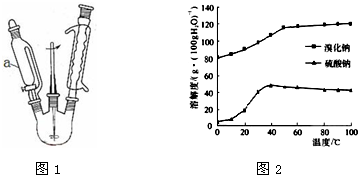
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
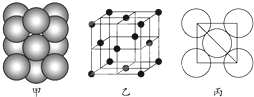 现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题.
现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题. 如图,违背了泡利不相容原理.
如图,违背了泡利不相容原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
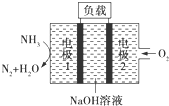
| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液pH值不变 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 用洁净的Pt蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,无k+ |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向溴水中滴入植物油,振荡后,油层显无色 | 溴不溶于油脂 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | pH相同的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) | |
| D. | 常温下,0.2 mol•L-1 NH4NO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得pH=9.6的溶液中:c(NO3-)>c(Na+)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com