
| A. | 参加反应的硝酸是0.92 mol | |
| B. | 合金中镁的质量5.9 g | |
| C. | 反应过程中转移的电子数为0.46 mol | |
| D. | 合金中含有铜0.092 mol |
分析 反应过程中硝酸被还原只产生8960mL的NO2气体和672mL的N2O4气体,由n=$\frac{V}{Vm}$可得二者物质的量分别为0.4 mol 和0.03 mol,设铜和镁的物质的量分别为a和b,则根据电子得失守恒可得2a+2b=0.46 mol,生成沉淀分别为氢氧化铜和氢氧化镁,由质量可得a•98 g/mol+b•58 g/mol=17.02 g,解两个方程式得a=0.092 mol,b=0.138 mol,即合金中含有铜0.092 mol,含有镁0.138 mol,参加反应的硝酸表现酸性的为0.46 mol,表现氧化性的为0.46 mol,共0.92mol,以此来解答.
解答 解:反应过程中硝酸被还原只产生8960mL的NO2气体和672mL的N2O4气体,由n=$\frac{V}{Vm}$可得二者物质的量分别为0.4 mol 和0.03 mol,设铜和镁的物质的量分别为a和b,则根据电子得失守恒可得2a+2b=0.46 mol,生成沉淀分别为氢氧化铜和氢氧化镁,由质量可得a•98 g/mol+b•58 g/mol=17.02 g,解两个方程式得a=0.092 mol,b=0.138 mol,即合金中含有铜0.092 mol,含有镁0.138 mol,
A.硝酸反应时表现酸性的为0.46 mol,表现氧化性的为0.46 mol,所以参加反应的硝酸是0.92 mol,故A正确;
B.由上述分析可知,含有镁0.138 mol,镁的质量为3.312 g,故B错误;
C.由生成NO2和N2O4的体积可得二者物质的量分别为0.4 mol 和0.03 mol,则硝酸得电子的物质的量为0.46 mol,即反应过程中转移的电子为0.46 mol,故C正确;D.由上述计算可知a=0.092 mol,即合金中含有铜0.092 mol,故D正确;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握硝酸的性质、电子和原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
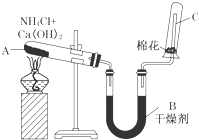 实验室中用如图所示装置制取干燥的氨气.
实验室中用如图所示装置制取干燥的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用FeCl3溶液鉴别化合物I和II | |
| B. | 物质I在NaOH醇溶液中加热可发生消去反应 | |
| C. | 物质II中所有原子可能位于同一平面内 | |
| D. | 物质III与足量H2加成所得产物分子中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案(只要求填写选用试剂) | ① | ② |
| 填试剂序号 | 填试剂序号 | |
| 实验现象 | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 | 溶液由无色变为黄色(或橙黄) |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO2-+H2O 或③Al3++4OH-═AlO2-+2H2O ④Mg2++2OH-═Mg(OH)2↓ | Cl2+2Br-=2Cl-+Br2 |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
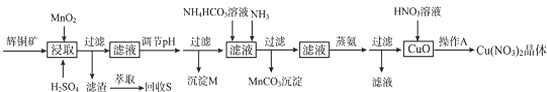
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com