
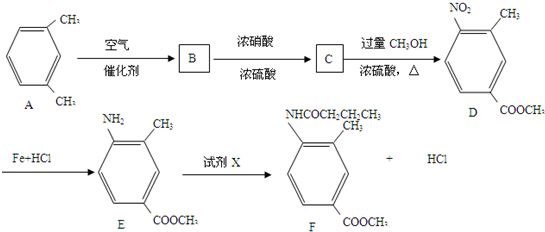
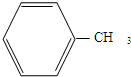
 制备化合物
制备化合物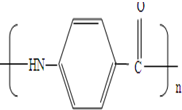
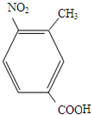 ,B发生硝化反应生成C,故C为
,B发生硝化反应生成C,故C为 ,A分子中一个甲基被氧化为羧基生成B.D转化E中硝基转化为氨基,发生还原反应,E与试剂X反应得到F,同时生成HCl,由E与F的结构简式可知,该反应为取代反应,故X为CH3CH2CH2COCl,(6)中由目标产物结构可知,应由对氨基苯甲酸发生水解反应生成,氨基引入可以通过硝基还原得到,羧基引入可以由酸性高锰酸钾氧化甲基得到,由于氨基易被氧化,故先发生甲苯消耗反应,再用酸性高锰酸钾氧化,然后在Fe、HCl作用下还原硝基,最后在催化剂条件下发生缩聚反应生成目标物质,据此解答.
,A分子中一个甲基被氧化为羧基生成B.D转化E中硝基转化为氨基,发生还原反应,E与试剂X反应得到F,同时生成HCl,由E与F的结构简式可知,该反应为取代反应,故X为CH3CH2CH2COCl,(6)中由目标产物结构可知,应由对氨基苯甲酸发生水解反应生成,氨基引入可以通过硝基还原得到,羧基引入可以由酸性高锰酸钾氧化甲基得到,由于氨基易被氧化,故先发生甲苯消耗反应,再用酸性高锰酸钾氧化,然后在Fe、HCl作用下还原硝基,最后在催化剂条件下发生缩聚反应生成目标物质,据此解答. ,B发生硝化反应生成C,故C为
,B发生硝化反应生成C,故C为 ,A分子中一个甲基被氧化为羧基生成B.D转化E中硝基转化为氨基,发生还原反应,E与试剂X反应得到F,同时生成HCl,由E与F的结构简式可知,该反应为取代反应,故X为CH3CH2CH2COCl,
,A分子中一个甲基被氧化为羧基生成B.D转化E中硝基转化为氨基,发生还原反应,E与试剂X反应得到F,同时生成HCl,由E与F的结构简式可知,该反应为取代反应,故X为CH3CH2CH2COCl, )的同分异构体满足下列条件:①含有苯环 ②含有酯基 ③能与银氨溶液反应,应是甲酸形成的酯,可以是甲酸苯甲醇形成的酯,可以是甲酸与甲基苯酚形成的酯,甲基苯酚有邻、间、对三种,故符合条件的同分异构体共有4种,故答案为:4;
)的同分异构体满足下列条件:①含有苯环 ②含有酯基 ③能与银氨溶液反应,应是甲酸形成的酯,可以是甲酸苯甲醇形成的酯,可以是甲酸与甲基苯酚形成的酯,甲基苯酚有邻、间、对三种,故符合条件的同分异构体共有4种,故答案为:4;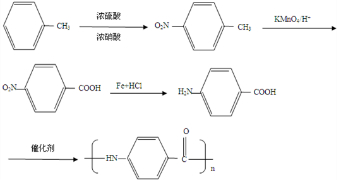 ,
, .
.


科目:高中化学 来源: 题型:
| A、若ω1=2ω2,则c1<2c2,V=100ml |
| B、若ω1=2ω2,则c1>2c2,V=100ml |
| C、若c1=2c2,则ω1<2ω2,V>100ml |
| D、若c1=2c2,则,ω1=2ω2,V=100ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
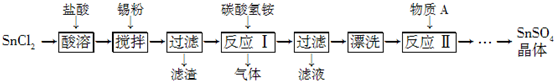
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
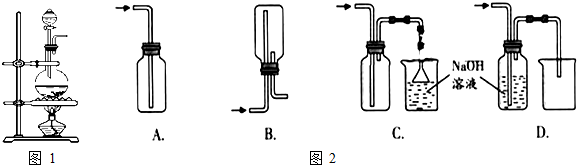
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去铁粉中混有少量铝粉,可加入过量的稀硫酸溶液,完全反应后过滤 |
| B、为测定熔融氢氧化钠的导电性,不能在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C、制备Fe(OH)3胶体,通常是将NaOH溶液滴入FeCl3溶液中 |
| D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②③ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com