
| A、1molH2含有的电子数 |
| B、通常状况下,22.4LCO2所含的分子数 |
| C、0.012kg12C所含的原子数 |
| D、1LO.5mol?L-1的CaCl2溶液所含的Cl-数 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、3:2:1 |
| C、6:3:2 |
| D、4:3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
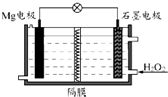 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图所示.该电池工作时,下列说法错误的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图所示.该电池工作时,下列说法错误的是( )| A、Mg电极是该电池的负极 |
| B、溶液中Cl-向石墨电极移动 |
| C、该装置中电子从Mg电极流向石墨电极 |
| D、H2O2在石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应物A的百分含量 |
| B、反应体系内分子的总数目 |
| C、平衡混合气体的密度 |
| D、平衡混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、△H=
| ||||
B、△H=
| ||||
C、△H=
| ||||
D、△H=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系的压强或混合气体密度不再改变 |
| B、各物质的浓度保持不变 |
| C、反应速率υ(N2):υ(H2):υ(NH3)=1:3:2 |
| D、单位时间内消耗0.1molN2,同时消耗0.3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、υ正=υ逆≠0时的状态 |
| B、NO2全部转变成N2O4的状态 |
| C、c(NO2)=c(N2O4)的状态 |
| D、N2O4不再分解的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.7g金属铝与足量盐酸反应失去的电子数为0.3NA | ||
| B、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | ||
| C、0.5mol/L Fe2(SO4)3溶液中,SO42-的数目为1.5NA | ||
D、C2H4和C3H6的混合物ag,所含原子总数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
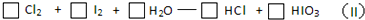
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com