
【题目】根据有机物的命名原则,下列命名正确的是( )
A.CH2Br—CH2Br 二溴乙烷B.CH3CH(C2H5)CH2CH2CH3 2—乙基戊烷
C.CH3OOCCH3 甲酸乙酯D.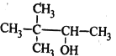 3,3—二甲基—2—丁醇
3,3—二甲基—2—丁醇
【答案】D
【解析】
A.卤代烃命名时,选含官能团的最长的碳链,故主链上有2个碳原子,从离官能团近的一端给主链上的碳原子进行编号,故在1号和2号碳原子上各有一个溴原子,名称为1,2-二溴乙烷,故A错误;
B.烷烃命名时,要选最长的碳链为主链,故主链上有6个碳原子,从离支链近的一端给主链上的碳原子编号,则在3号碳原子上有一个甲基,名称为3-甲基己烷,故B错误;
C.根据酸和醇反应生成酯,酯命名为某酸某酯,CH3OOCCH3是由甲醇和乙酸反应生成的,故为乙酸甲酯,故C错误;
D.醇在命名时,要选含官能团的最长碳链为主链,故主链上有4个碳原子,从离官能团近的一端给主链上的碳原子进行编号,则-OH在2号碳原子上,在3号碳原子上有2个甲基,故名称为:3,3-二甲基-2-丁醇,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的C/Na4Fe(CN)6--钠离子电池是一种新型电池。下列有关说法正确的是
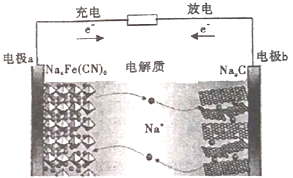
A. 电极a在放电时做正极,充电时做阴极
B. 放电时,电极b上的电极反应为:NaxC-e-=Na++Nax-1C
C. 电池工作时,Na+向电板b移动
D. 该电池通过Na+的定向移动产生电流,不发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
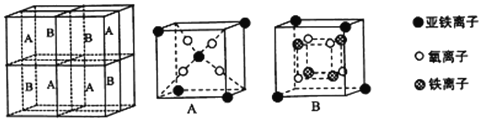
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予研发锂离子电池的三位科学家。磷酸亚铁锂(![]() )常用于生产锂离子电池,请回答下列问题:
)常用于生产锂离子电池,请回答下列问题:
(1)![]() 中Li元素的化合价为______。
中Li元素的化合价为______。
(2)某锂离子电池放电时,![]() 以阳离子的形式脱离
以阳离子的形式脱离![]() 电极后,剩余的
电极后,剩余的![]() 本身会转变为一种电中性化合物,该化合物的化学式为____,放电过程中
本身会转变为一种电中性化合物,该化合物的化学式为____,放电过程中![]() ;发生了______(填“氧化”或“还原”)反应。
;发生了______(填“氧化”或“还原”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应。
(1)该反应的化学方程式是__。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
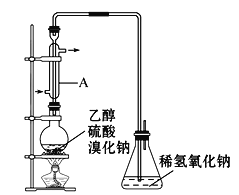
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
已知反应物的用量:0.3molNaBr(s);0.25mol乙醇(密度为0.80g·mL-1);36mL硫酸。
请回答下列问题。
(2)仪器A最好更改为___。
(3)反应时若温度过高,则有SO2生成,同时观察到还有一种红棕色气体产生。反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的__。
a.饱和食盐水 b.稀氢氧化钠溶液 c.乙醇 d.四氯化碳
(4)本实验的产率为80%,则可制取溴乙烷___g。
(5)写出由溴乙烷合成乙二醇的路线___。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,该电池发生的总反应为2Li+P2VP·nI2![]() P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
A.该电池放电时,锂电极发生还原反应
B.该电池放电时,碘离子移向正极
C.P2VP和I2的复合物是绝缘体,不能导电,充电时与外电源的负极相连
D.放电时正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.2-丁烯不存在顺反异构体
B.已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种
C.菲的结构简式为 ,它与硝酸反应,可生成4种一硝基取代物
,它与硝酸反应,可生成4种一硝基取代物
D.乙醛的核磁共振氢谱中有二个峰,峰面积之比是1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(MoO3)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分
为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
则2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=______(用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①下列说法正确的是______(填字母)。
a.气体的密度不变,则反应一定达到了 平衡状态
b.气体的相对分子质量不变,反应不定处于 平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4 molL-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度______(填“>“<“或“=“)1.4 molL-1。
(3)在2L恒容密闭容器中充入1.0 molS2(g)和1.5 mol O2(g),若仅发生反应:S2(g)+2O2(g)2SO2(g),5 min后反应达到平衡,此时容器压强为起始时的80%,则0~5 min内,S2(g)的反应速率为______molL-1min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H.测得氧气的平衡转化率与起始压强、温度的关系如图所示:
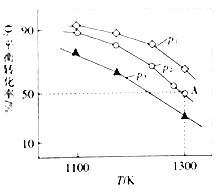
①△H______(填“>“*<“或“=“)0;比较p1、p2、p3的大小:______
②若初始时通入7.0molO2,p2为7.0 kPa,则A点平衡常数Kp=______(用气体平衡分压代替气体平衡浓度计算。分压=总压×气体的物质的量分数,写出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com