
| A. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1=-a kJ•mol-1, ②2H2(g)+O2(g)═2H2O(l)△H2=-b kJ•mol-1, 则a>b,△H1<△H2 | |
| B. | 同温同压下,SO2(g)+2CO(g)═2CO2(g)+S(l)在有无催化剂条件下的△H不同 | |
| C. | 任何酸与碱发生中和反应生成1mol H2O的过程中,能量变化均相同 | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含2.0 g氢氧化钠的稀溶液与稀盐酸完全中和,放出热量2.865 kJ |
分析 A、生成液态水放出热量多;
B、△H与反应的条件无关;
C、只有强酸和强碱的稀溶液中和生成1mol水时,放出的热量才相同;
D、强酸和强碱反应生成1mol水放出的热量为中和热.
解答 解:A、生成液态水放出热量多,所以a<b,则△H1>△H2,故A错误;
B、△H与反应的条件无关,所以同温同压下,SO2(g)+2CO(g)═2CO2(g)+S(l)在有无催化剂条件下的△H相同,故B错误;
C、只有强酸和强碱的稀溶液中和生成1mol水时,放出的热量才相同,弱酸弱碱没有完全电离,电离时需吸收能量,放出的热量少,故C错误;
D、已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20.0g NaOH物质的量为0.5mol的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,故D正确;
故选D.
点评 本题主要考查了化学反应中能量变化,注意知识的积累,难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:解答题

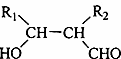
 .
. .
.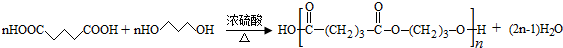 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | 向一定量NaOH溶液中加入稀H2SO4 | 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液 | 向相等质量的锌粉和铁粉中,分别加入质量分数相同的稀盐酸 |
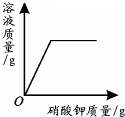 | 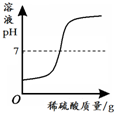 | 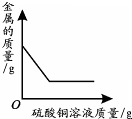 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、氯化铁晶体常用于净水 | |
| B. | 实验室制氢气时加CuSO4可加快反应速率 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 实验室通常使用热的纯碱溶液去除油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序:rZ>rY>rX>rW | |
| B. | 单质Z易溶在元素Q和Z形成的化合物QZ2中 | |
| C. | Q、Y的最高价氧化物的水化物之间能发生反应 | |
| D. | 在相同条件下Z元素的氢化物沸点高于W元素的氢化物沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下能导电的物质一定是电解质 | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1=0.1mol/L和c2=0.01mol/L,c(H+)分别为amol/L和bmol/L则a=10b | |
| C. | 向0.1mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 | |
| D. | 弱电解质溶液的导电能力可能比强电解质溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
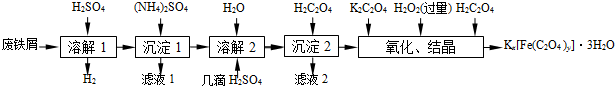
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | 2HCl$\frac{\underline{\;通电\;}}{\;}$Cl2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com