


科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 |
+2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
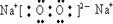
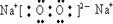
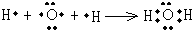
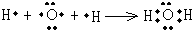
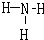
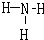
 2SO3(g);△H=-196.8kJ/mol
2SO3(g);△H=-196.8kJ/mol 2SO3(g);△H=-196.8kJ/mol
2SO3(g);△H=-196.8kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)现有10种元素的性质、数据如下表所列,它们均为短周期元素。回答下列问题:
|
| A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-9m) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 | 0.102 | 0.037 |
| 最高或最低 化合价 |
| +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6[ | +1 |
| -2 |
|
| -3 | -1 |
| -3 |
| -2 |
|
(1)H的元素符号是 ; B在元素周期表中的位置是(周期、族)
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是 。
(3)化合物F2A2的电子式是: ,构成该物质的化学键类型为________________(填“离子键、极性键或非极性键”)
当F2A2与J2A的反应中有3.01×1023个电子转移时,参加反应的F2A2的质量是 g。
(4)用电子式表示J2A的形成过程: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)
现有10种元素的性质、数据如下表所列,它们均为短周期元素。
|
| A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 |
| +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 |
| -2 |
|
| -3 | -1 |
| -3 |
| -2 |
|
回答下列问题:
(1)D的元素名称是 ,
H的元素符号是 。
B在元素周期表中的位置是(周期、族)
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是 。
化合物F2A2的电子式是: ,构成该物质的化学键类型为________________
(3)用电子式表示A的简单氢化物的形成过程如下: ;
G的氢化物的结构式为 。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6 kJ热量,写出其热化学方程式 。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com