
【题目】下列有关物质的组成、结构和性质的说法中正确的是
A.用甘氨酸(![]() )和丙氨酸(
)和丙氨酸(![]() )缩合最多可形成四种二肽
)缩合最多可形成四种二肽
B.浓硫酸可以使蛋白质变黄,称为颜色反应,常用来鉴别部分蛋白质
C.在一定条件下,CH3CO18OH和C2H5OH反应可生成 CH3CO18OC2H5
D.HCOOH与OHCCH2OH属于同系物,均能使酸性KMnO4溶液褪色
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】“达芦那韦”是抗击新型冠状病毒潜在用药,化合物M是它的合成中间体,其合成路线如下:
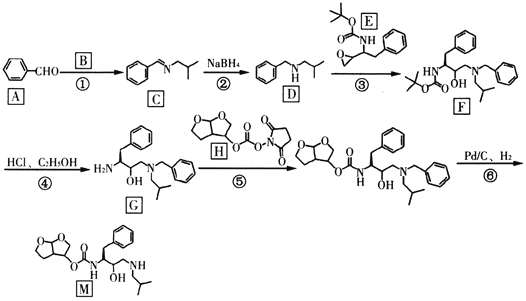
已知:R1CHO![]()
![]()
回答下列问题:
(1)有机物A的名称是______________;反应②反应类型是__________。
(2)物质B的结构简式是____________;E的分子式为_____________。
(3)G中含氧官能团的名称是________;F中有________个手性碳原子。
(4)请写出反应⑤的化学反应方程式_____________。
(5)物质N是C的一种同分异构体,写出满足下列条件的一种同分异构体的结构简式_______。
①分子结构中含有苯环和氨基,氨基与苯环直接相连;②能使溴水褪色;③核磁共振氢谱有6组峰,峰面积之比为6∶3∶2∶2∶1∶1。
(6)设计由苯甲醇和CH3NH2为原料制备![]() 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:

(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量稀硝酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素
C.苯与浓溴水反应制取溴苯
D.![]() 溶液
溶液![]() 和
和![]() 溶液
溶液![]() 混合后加入
混合后加入![]() 的乙醛溶液
的乙醛溶液![]() ,加热煮沸观察沉淀的颜色
,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____________方法区分晶体、准晶体和非晶体。
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为______。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,写出一种与[H2F]+互为等电子体的阴离子是_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_________。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 范德华力 E 配位键
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是_____________;
②CuF的晶胞结构如图1。F-填充在Cu+围成的_______空隙中,空隙填充率为________%。
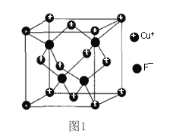
Ⅱ.AA705合金(含Cu、Al、Zn、Mg和Ti)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。
(5)CN-、NH3、H2O和OH-等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含________ molσ键,中心离子的配位数为__________。
钛晶体有两种品胞,如图所示。
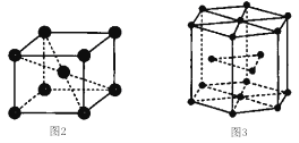
①如图2所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图3中六棱柱边长为x pm,高为y pm。该钛晶胞密度为D g·cm-3,NA为______mol-1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸和一水合氨是重要的弱酸和弱碱,常温下,其电离常数如下表所示。回答下列问题:
弱电解质 | H2CO3 | NH3·H2O | |
电离常数 |
|
|
|
(1)碳酸的一级电离方程式为______,二级电离常数表达式![]() ________。
________。
(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是_______(写化学式),混合溶液中![]() 、
、![]() 、
、![]() 、
、![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
(3)![]() 和
和![]() 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为![]() ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数![]() _______。(保留2位有效数字)。
_______。(保留2位有效数字)。
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则![]() +____+_____。
+____+_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为______。
(2)AlCl3可作以下反应的催化剂。
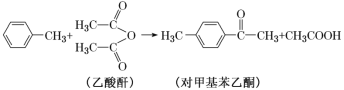
①乙酸酐分子中碳原子轨道的杂化类型为______。
②1 mol对甲基苯乙酮分子中含有的σ键为______。
③CH3COOH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为__________。
④单个AlCl3气态分子的空间构型为___________,AlCl3可与Cl-形成![]() ,与
,与![]() 互为等电子体的分子为________。
互为等电子体的分子为________。
(3)某遮光剂的晶胞如图所示,由晶胞可知n=______。
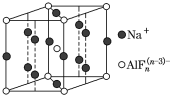
查看答案和解析>>
科目:高中化学 来源: 题型:
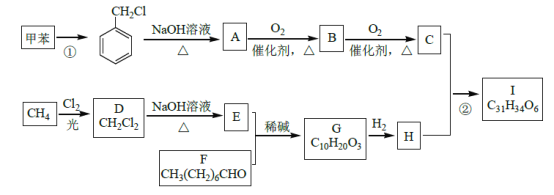
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
已知:a. 
![]()
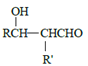
b. 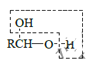
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件,W的可能结构有__种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备 的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A![]() B---
B---![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢材在社会发展中应用广泛。为研究某种碳素钢(含少量碳和硫)的成分,科研小组进行了如下探究活动:称取碳素钢(已除表面氧化物)97.50 g放入耐高温反应管中与O2反应,除去未反应的O2,收集到干燥混合气体X 1.12 L(已折算成标准状况下的体积)。
(1)碳素钢属于___________材料(填标号)
A.有机高分子材料 B.金属材料 C.无机非金属材料 D.复合材料
(2)科研小组用下图所示实验装置检验混合气体X的组成。
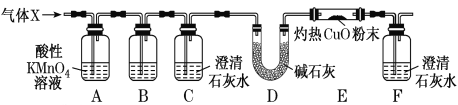
①装置B中的试剂是______________,装置C的作用是______________。
②若观察到_________________(填实验现象),证明X中含有CO。
(3)反应后,耐高温反应管内固体中除含有Fe3+之外,还可能含有Fe2+。要确定其中的Fe2+,可选用________(填序号)。
a.稀H2SO4和KMnO4溶液 b.KSCN溶液和铁粉
c.稀盐酸和K3[Fe(CN)6]溶液 d.KSCN溶液和氯水
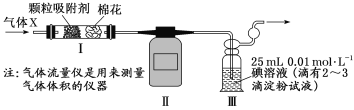
(4)科研小组用下图所示装置(部分)测定SO2的体积分数,并计算碳素钢的含碳量。将气体X 缓慢通过实验装置,当观察到___________________(填实验现象)时,停止通气,此时气体流量仪显示的流量为224 mL(已换算成标准状况下的体积)。装置Ⅲ中的化学反应方程式为________________,碳素钢中碳元素的质量分数为_________(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com