
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设:
假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图: 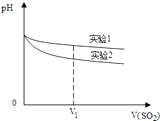
实验1中溶液pH变小的原因是;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
实验步骤 | 实验现象 | 结论 |
实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
实验4: |
【答案】
(1)无现象;白色沉淀生成
(2)SO2溶于水后生成H2SO3 , 亚硫酸显酸性,故pH值减小;3SO2+2H2O+2NO3﹣=2NO+4H++3SO42﹣
(3)无现象;在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体;有白色沉淀生成;假设二成立
【解析】解:(1)因盐酸的酸性大于亚硫酸,则二氧化硫与氯化钡不反应,则实验1中无现象;
Ba(NO3)2溶液中缓慢通入纯净的SO2气体,发生氧化还原反应生成硫酸钡沉淀,则实验2中生成白色沉淀,假设一成立,
所以答案是:
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 白色沉淀生成 |
·(2)实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3 , 亚硫酸显酸性,故pH值减小;实验2中溶液pH小于实验1的原因是3SO2+2H2O+2NO3﹣=2NO+4H++3SO42﹣ ,
所以答案是:SO2溶于水后生成H2SO3 , 亚硫酸显酸性,故pH值减小;3SO2+2H2O+2NO3﹣=2NO+4H++3SO42﹣;(3)设计实验验证假设二,实验3与4为对比实验,实验4中未经脱O2处理,实验4中出现白色沉淀,实验3中无现象可知假设二成立,
所以答案是:
实验步骤 | 实验现象 | 结论 |
实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设二成立 |
实验4:在盛有未经脱O2处理的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 有白色沉淀生成 |


科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐的分类依次排列,正确的是( )
A. 硫酸、纯碱、石膏 B. 硫酸、烧碱、胆矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学方程式中,能够用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
A. BaCl2+K2SO4=BaSO4↓+2KCI
B. BaCO3+H2SO4=BaSO4↓+CO2↑+H2O
C. Ba(OH)2+H2SO4=BaSO4↓+2H2O
D. Ba(OH)2+2KHSO4=BaSO4↓+K2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A. 反应在c点达到平衡状态
B. 反应物浓度:a点小于b点
C. 反应物的总能量低于生成物的总能量
D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如右图所示,下列判断正确的是

A. 50min时,pH=2和pH=7时R的降解百分率相等
B. 溶液酸性越强,R的降解速率越小
C. R的起始浓度越小,降解速率越大
D. 在20~25 min之间,pH=10时R的平均降解速率为0.04mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述正确的是( )
A.反应中转移电子的总数为0.3mol
B.反应过程中,消耗硝酸的物质的量为0.3mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.开始加入合金的质量可能为3.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能与金属钠反应放出气体,又能与纯碱作用放出气体的是( )
A. CH3CH2OH B. CH3COOH C. H2O D. C6H12O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( ) 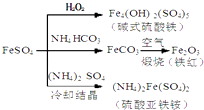
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影晌生成H2的总置,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液C.(NH4)2SO4粉末D.K2SO4固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com