
| A. | Ka=$\frac{2×1{0}^{-7}}{0.1V-2}$ | B. | V=$\frac{2×1{0}^{-7}}{0.1{K}_{a}-2}$ | ||
| C. | Ka=$\frac{2×1{0}^{-7}}{V+20}$ | D. | Ka=$\frac{2×1{0}^{-8}}{V}$ |
分析 当滴加VmLCH3COOH溶液时,混合溶液的pH=7,此时溶液中c(OH-)=c(H+)=10-7mol/L,由电荷守恒c(Na+)=c(CH3COO-)=$\frac{2}{(V+20)}$mol/L,根据物料守恒c(CH3COO-)+c(CH3COOH)=$\frac{0.1V}{V+20}$mol/L,联立计算c(CH3COOH),CH3COOH的电离平衡常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$,代入Ka表达式进行计算.
解答 解:当滴加VmLCH3COOH溶液时,混合溶液的pH=7,此时溶液中c(OH-)=c(H+)=10-7mol/L,
由电荷守恒:c(OH-)+c(CH3COO-)=c(H+)+c(Na+),可知c(Na+)=c(CH3COO-)=$\frac{0.02L×0.1mol/L}{(20+V)×1{0}^{-3}L}$=$\frac{2}{(V+20)}$mol/L,
根据物料守恒c(CH3COO-)+c(CH3COOH)=$\frac{0.1V}{V+20}$mol/L,则c(CH3COOH)=($\frac{0.1V}{V+20}$-$\frac{2}{(V+20)}$)mol/L=$\frac{0.1V-2}{V+20}$mol/L,
CH3COOH的电离平衡常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{\frac{2}{V+20}×1{0}^{-7}}{\frac{0.1V-2}{V+20}}$=$\frac{2×1{0}^{-7}}{0.1V-2}$,则V=$\frac{2×1{0}^{-7}+2{K}_{a}}{0.1{K}_{a}}$,
故选:A.
点评 本题考查弱电解质电离平衡常数,关键是利用电荷守恒、物料守恒确定离子浓度,难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| C. | AlO2一的浓度为0.1 mol/L的溶液中:K+、Na+、HCO3-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C3H6 | C. | C2H6 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差26 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
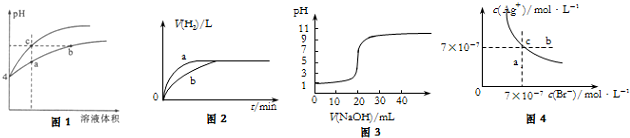
| A. | 图1某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH 变化曲线,用等浓度NaOH溶液分别和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc | |
| B. | 图2中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)与同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. | 图3表示25℃用0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1 CH3COOH溶液得到的滴定曲线 | |
| D. | 图4表示某温度下AgBr在水中的沉淀溶解平衡曲线的图象,向AgBr的饱和溶液中加入NaBr固体,可以使溶液由c点到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C的质量数为14g•mol-1 | B. | 14C与12C是两种不同的元素 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与14N中子数一定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Mg2+、S2-、Cl- | B. | H+、Na+、SO42-、NO3- | ||
| C. | K+、Ba2+、OH、SO32- | D. | Na+、K+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)
根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$) +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com