
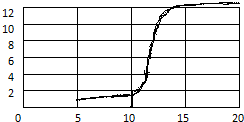
| ①加入NaOH溶液的体积(mL) | 5.0 | 7.5 | 10.7 | 12.0 | 12.3 | a | 12.8 | 13.0 | b | 17.5 | 20.0 |
| ②溶液pH | 1.3 | 1.5 | 2.0 | 2.6 | 3.0 | 7.0 | 11.2 | 11.4 | 12.0 | 12.4 | 12.5 |
| ③指示剂的颜色 | 无 | 无 | 无 | 无 | 无 | 粉红 | 红 | 红 | 红 | 红 | 红 |

| V(标准)×c(标准) |
| V(待测) |
| 25mL×0.1mol/L |
| 0.2mol/L |
| 1×10-14 |
| 10-12 |
| b×0.2mol/L-25mL×0.1mol/Ll |
| b+25mL |
 ,
, ;
;| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
A、HCO
| ||||
B、Al3+、K+、OH-、SO
| ||||
C、Fe3+、I-、SO
| ||||
D、K+、Al3+、SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 10 | 20 | 30 | 60 |
| pH | 4 | 3 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中XZ的物质的量浓度随时间变化的曲线.
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中XZ的物质的量浓度随时间变化的曲线.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用导线把锌片与铜片连接好,然后平行插入稀硫酸中(如图所示),下列说法正确的是( )
用导线把锌片与铜片连接好,然后平行插入稀硫酸中(如图所示),下列说法正确的是( )| A、铜为负极 |
| B、铜片上无气泡产生 |
| C、锌片逐渐溶解 |
| D、锌片上有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com