
【题目】X、Y、Z、W为四种短周期主族元素,且原子序数依次增大。已知X的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的最外层电子数是W原子最外层电子数的2倍,Z原子最外层只有1个电子。下列说法正确的是( )
A. 离子半径:![]() B. Z和Y形成的化合物可能含有非极性键
B. Z和Y形成的化合物可能含有非极性键
C. 氢化物的稳定性:![]() D. 最高价氧化物对应水化物的碱性:
D. 最高价氧化物对应水化物的碱性:![]()
【答案】B
【解析】
Y是地壳中含量最高的元素,应为O元素,X的最外层电子数是其电子层数的2倍,且原子序数比Y小,应为C元素,Y原子的最外层电子数是W原子最外层电子数的2倍,则W的最外层电子数为3,应为Al,Z原子最外层只有一个电子,且原子序数比W小,比Y大,应为Na元素,结合对应单质、化合物的性质以及元素周期律知识解答该题。
由题述条件知,X是碳元素,Y是氧元素,Z是钠元素,W是铝元素。
A、根据电子层相同的离子,核电荷数小半径大,离子半径:![]() ,故A错误;
,故A错误;
B、Z和Y形成的化合物![]() 中含有非极性键,故B正确;
中含有非极性键,故B正确;
C、同周期氢化物的稳定性从左到右稳定性增强,氢化物稳定性:![]() ,故C错误;
,故C错误;
D、根据元素的金属性越强最高价氧化物对应水化物的碱性越强,碱性:![]() ,故D错误。
,故D错误。
故选B。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】喹硫平可用于精神疾病的治疗,它的合成路线如下:
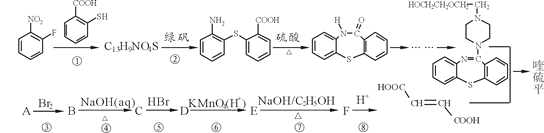
(1)写出C13H9NO4S中所有含氧官能团的名称__________。
(2)A属于烃,且相对分子质量是54,写出A的结构简式_______________。
(3)反应①~⑤中属于取代反应的有____(选填序号)。
写出反应⑦的化学方程式________________。
(4)流程中设计反应⑤和⑦的目的是_____________________。
(5)物质C的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有____种。
(6)已知:苯环上的羧基为间位定位基,如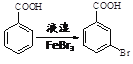 。写出以
。写出以![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下:![]() 。_____________
。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是
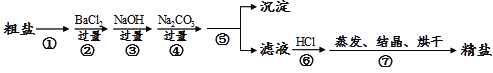
A. 实验过程中①、⑤步骤的操作分别是溶解、过滤
B. 实验过程中步骤④的目的是仅除去溶液中的Ca2+
C. 实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈)
D. 实验过程中②、④步骤互换,对实验结果不影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是科学研究的重要方法,下列物质分类正确的是( )
A. 非电解质:乙醇、氯气B. 酸性氧化物:NO、![]()
C. 胶体:豆浆、葡萄糖溶液D. 离子化合物:NaH、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的 NaOH 溶液,溶液中pOH 与 pH 的变化关系如图所示,则正确的是( )
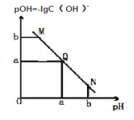
A. M 点所示溶液导电能力强于 Q 点
B. N 点所示溶液中 c(Na+)>c(CH3COO-)
C. Q 点所示的溶液 pH 一定等于 7
D. Q 点加入 NaOH 溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含![]() 、FeO,杂质为
、FeO,杂质为![]() 和
和![]() 等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)FeOOH中Fe元素的化合价为____。
(2)“酸溶”时,所选择的硫酸为溶质质量分数49%,密度![]() ,该硫酸物质的量浓度是___
,该硫酸物质的量浓度是___![]() ,
,![]() 反应的离子方程式为____。
反应的离子方程式为____。
(3)滤渣Ⅰ的主要成分是![]() 和___(填化学式);
和___(填化学式);![]() 被
被![]() 还原的离子方程式为_____。
还原的离子方程式为_____。
(4)“氧化”中,需检验溶液中的离子是否氧化完全,所选用的试剂是____。
(5)滤液Ⅱ中溶质是___(填化学式);洗涤固体的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类文明进步息息相关,下列说法错误的是( )
A. 蚕丝的主要成分是蛋白质,属于天然高分子材料
B. 汉代烧制出“明如镜、声如磬”的瓷器,主要化学成分是硅酸盐
C. 2022年冬奥会聚氨酯速滑服,是无机非金属材料
D. 城市公交系统推广的清洁燃料压缩天然气“![]() ”、液化石油气“
”、液化石油气“![]() ”,主要成分都是烃
”,主要成分都是烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
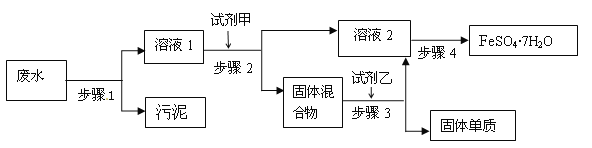
(1)步骤1的主要操作是___,需用到的玻璃仪器除烧杯外还有___。
(2)固体混合物是____(填化学式)
(3)步骤3中发生反应的化学方程式为___。
(4)步骤4中涉及的操作是:蒸发浓缩、___、过滤、洗涤、干燥。
(5)火法制得的粗铜中常混有少量氧化亚铜(Cu2O),氧化亚铜溶于稀硫酸溶液变蓝。试写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁![]() 是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
已知:①氮化镁极易与水反应;②实验室在加热条件下用饱和![]() 溶液和饱和
溶液和饱和![]() 溶液混合制备
溶液混合制备![]() ;③焦性没食子酸溶液用于吸收少量
;③焦性没食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制备氮化镁。
他们选择下列装置设计实验(装置可重复使用):
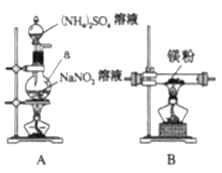
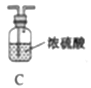

(1)仪器a的名称是____,氮化镁的电子式是____。
(2)气体从左至右,装置连接顺序为____。(填代号)
(3)写出A中发生反应的化学方程式:____。
(4)用化学方法检验产品中含有氮化镁![]() ,设计实验方案:____。
,设计实验方案:____。
Ⅱ.测定产品纯度。
利用如图装置测定氮化镁产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是__。
(6)取产品质量为wg,开始量气管读数为![]() ,最终量气管读数为
,最终量气管读数为![]() (折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
(折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com