
【题目】(1)标准状况下,33.6 L氧气的物质的量为________mol;标准状况下,2 mol氢气的体积为________L。
(2)标准状况下,6 g氢气的体积为________L;标准状况下,体积为11.2 L的CO2的质量为________g。
(3)标准状况下,11.2 L氯气的分子数目是________;标准状况下,1.204×1023个氧气分子的体积是________L。
(4)标准状况下,某气体的密度为1.25 g·L-1,则其摩尔质量为________g·mol-1。
(5)实验室用H2O2和MnO2制备O2,2H2O2![]() 2H2O+O2↑,现有34 g H2O2,可制得O2在标准状况下的体积是__________。
2H2O+O2↑,现有34 g H2O2,可制得O2在标准状况下的体积是__________。
【答案】1.5 44.8 67.2 22 0.5NA 4.48 28 11.2L
【解析】
(1)标准状况下,根据公式![]() 计算氧气的物质的量,标准状况下,根据公式
计算氧气的物质的量,标准状况下,根据公式![]() 计算氢气的体积。
计算氢气的体积。
(2)标准状况下,根据公式计算![]() 计算氢气的物质的量,再计算体积;标准状况下,先根据公式
计算氢气的物质的量,再计算体积;标准状况下,先根据公式![]() 计算CO2的物质的量,再计算质量。
计算CO2的物质的量,再计算质量。
(3)标准状况下,先根据公式![]() 计算氯气的物质的量,再计算分子数目;标准状况下,先计算氧气分子的物质的量,再计算体积。
计算氯气的物质的量,再计算分子数目;标准状况下,先计算氧气分子的物质的量,再计算体积。
(4)标准状况下,根据公式![]() 计算摩尔质量。
计算摩尔质量。
(5)先计算H2O2物质的量,根据2H2O2~2H2O~O2关系式得O2物质的量,再计算标准状况下的体积。
(1)标准状况下,33.6 L氧气的物质的量为![]() ;标准状况下,2 mol氢气的体积为
;标准状况下,2 mol氢气的体积为![]() ;故答案为:1.5;44.8。
;故答案为:1.5;44.8。
(2)标准状况下,6 g氢气的物质的量为![]() ,体积为
,体积为![]() ;标准状况下,体积为11.2 L的CO2的物质的量为
;标准状况下,体积为11.2 L的CO2的物质的量为![]() ,质量为
,质量为![]() ;故答案为:67.2;22。
;故答案为:67.2;22。
(3)标准状况下,11.2 L氯气的物质的量为![]() ,分子数目是
,分子数目是![]() ;标准状况下,1.204×1023个氧气分子的物质的量为
;标准状况下,1.204×1023个氧气分子的物质的量为![]() ,体积是
,体积是![]() ;故答案为:0.5NA;4.48。
;故答案为:0.5NA;4.48。
(4)标准状况下,某气体的密度为1.25 g·L-1,则其摩尔质量为![]() ;故答案为:28。
;故答案为:28。
(5)34 g H2O2物质的量为![]() ,根据2H2O2~2H2O~O2关系式得O2物质的量
,根据2H2O2~2H2O~O2关系式得O2物质的量![]() ,标准状况下的体积是
,标准状况下的体积是![]() ;故答案为:11.2L/span>。
;故答案为:11.2L/span>。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是( )
A. NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B. 漂白粉溶液呈碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
C. 酸性条件下用H2O2将海带灰中I-氧化:H2O2+2I-+2H+=I2+2H2O
D. 氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应3B(g) ![]() C(g)+D(g)的说法不正确的是( )
C(g)+D(g)的说法不正确的是( )
A.某时刻测得v正(B)=v逆(B),说明反应达到了化学平衡状态
B.反应达到化学平衡后,反应物和生成物的浓度不再改变
C.反应达到平衡后,反应就停止了
D.上述反应中,B不可能全部转化为C和D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度的恒容的密闭容器中,下列叙述不是可逆反应2C(g) ![]() A(g)+3B(g)达到平衡状态标志的是( )
A(g)+3B(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等 ②单位时间内生成a mol A,同时消耗3a mol B
③A、B、C的浓度不再变化 ④混合气体的密度
⑤混合气体的总压强不再变化 ⑥若C为固体,A的体积分数不再变化
A. ①② B. ④⑥ C. ④⑤ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)
A. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B. 提高CO2充气压力,饮料中c(A–)不变
C. 当pH为5.0时,饮料中![]() =0.16
=0.16
D. 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(![]() )+c(
)+c(![]() )+c(OH–)–c(HA)
)+c(OH–)–c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述不正确的是
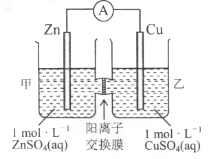
A. 锌电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)与氮同一主族,As原子比N原子多两个电子层。可以形成As2S3、As2O5、H3AsO3、H3AsO4,等化合物,有着广泛的用途。回答下列问题:
(1)As的原子序数为______________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式____________。该反应需要在加压下进行,原因是___________。
(3)己知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)
H2(g)+2O2(g)=H3AsO4(s) ![]()
H2(g)+![]() O2(g)=H2O(l)
O2(g)=H2O(l) ![]()
2As(s)+![]() O2(g)=As2O5(s)
O2(g)=As2O5(s) ![]()
则反应As2O5(s)+3 H2O(l)=2 H3AsO4(s)的![]() =______________________。
=______________________。
(4)298K肘,将2OmL 3xmol·L-1 Na3AsO3、20m L3xmol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是_____(填标号)。
a.v(I-)=2v(AsO33-) b.溶液的pH不再变化
c.c(I-)=ymol·L-1 d.c(AsO43-)/c(AsO33-)不再变化
②tm时,v正____v逆(填“大于”、“小于”或“等于”)。
③) tm时v逆____tn时v逆(填“大于”、“小于”或“等于”),理由是___________。
④若平衡时溶液的pH=14,则该反应的平衡常数为_____(用x、y表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学有关的文献,理解正确的是
A. 《石灰吟》中“…烈火焚烧若等闲…要留清白在人间”,其中“清白”指氢氧化钙
B. 《咏煤炭》中“凿开混沌得乌金…不辞辛苦出山林”,其中“乌金”的主要成分是木炭
C. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中的“碱”是一种盐溶液
D. 《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质…”文中的“丝”“麻”、“裘”主要成分均属于多糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)下列各组物质:
①金刚石和C60 ②H、D和T ③ 和
和 ④CH3(CH2)2CH3 和 (CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O
④CH3(CH2)2CH3 和 (CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O
互为同位素的是(填序号,下同)___,互为同素异形体的是______,互为同系物的是_____,属于同分异构体的是_______。
(2)书写下列物质的结构简式:
①2,6-二甲基-4-乙基辛烷:_________________
②2-甲基-1-戊烯:____________________
(3)按要求填空:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式: ______;
②C6H13Cl的同分异构体共有______种,请写出结构中仅含有四个甲基的所有同分异构体的结构简式:__________________。
③用系统命名法命名 ______________________________
______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com