
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
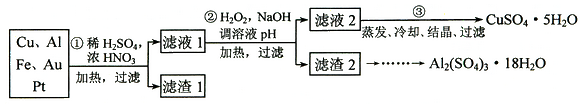
(1) 第①步Cu与酸反应的离子方程式为 。
(2) 第②步加H2O2的作用是 。
(3) 该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定(原理为I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 滴定过程中可选用________作指示剂,滴定终点的现象是____________。
② CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标
准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+。
③ 写出计算CuSO4·5H2O质量分数的表达式w=___________。
(4)请补充完整从滤渣2制备Al2(SO4)3·18H2O的实验方案:边搅拌边向滤渣2中加入_________至滤渣不再溶解,过滤, 在滤液中 、过滤、用水洗涤固体2-3次,在50℃下干燥,得到Al2(SO4)3·18H2O。(可选试剂有:硫酸溶液、氢氧化钠溶液、氨水、二氧化碳)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。
其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为____________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;
③ 。
(3) 若pH过高,则对产品的影响是 。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果SO42-、Fe3+、Al3+和X四种离子以物质的量之比为4:2:1:1共同存在于同一种溶液中,那么X可能是
A. Cl- B. Na+ C. CO32- D. PO43-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 金属使用的年代与金属的性质无关
B. 铁能置换出CuSO4溶液中的铜,故银也能置换出CuSO4溶液中的铜
C. 金属原子最外层电子数越少,其还原性越强
D. 将金属钠投入CuSO4溶液中,得不到金属铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CO2的摩尔质量为44g
B.标准状况下,2.24L CCl4所含的原子数为0.5NA
C.5.4g的H2O中约有1.806×1023个分子
D.50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习兴趣小组想利用高岭土(其主要成分是Al2O3·2SiO2·2H2O)制备新型的净水剂。实验流程如下:

其中滤液C就是欲制备的净水剂。
试完成下列问题:
(1)写出混合物A、B,滤液C、沉淀D的主要成分:
A________;B________;C________;D________。
(2)写出高岭土与纯碱加热熔融的两个化学方程式:________、________。
(3)该实验中,熔融高岭土、纯碱的混合物可以选用的坩埚有________。
A.玻璃坩埚 B.瓷坩埚
C.氧化铝坩埚 D.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
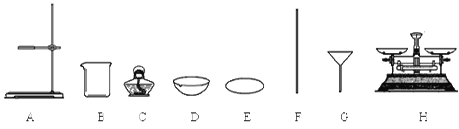
(1)D的名称是 ;
(2)提纯的步骤是:溶解、 过滤 、 ;
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是 ;
(4)该实验中多次利用仪器B (填名称)和仪器 (填字母序号),且该仪器使用了 次 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用特殊的方法把固体物质加工到纳米级的超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是
A. 溶液 B. 悬浊液 C. 胶体 D. 乳浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com