
已知:C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)====C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)====H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为:
A.4a+4b+4c B.2a-2b+6c C.2a-2b+2c D.2a-6b+2c
科目:高中化学 来源: 题型:
4.6 g铜镁合金完全溶解于100 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到4 480 mL NO2和336 mL N2O4的混合气体(标准状况),向反应的溶液中加入1.0 mol·L-1 NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是69∶46
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO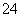 )≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1×10-13 mol·L-1
C.所加烧碱溶液的pH=13.0
D.所得溶液中c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原子结构、元素性质的说法正确的是:
A.随原子序数的递增,元素原子的核外电子数逐渐增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素原子的最外层电子数相同,则元素最高正价一定相同
D.电子层结构相同的微粒,其化学性质一定相似
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是:
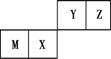
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
.有Wn+、Xm+、Ym-、Zn-(m>n)四种离子,且W、X、Y、Z四种原子的M电子层中的电子数均为奇数。下列说法中正确的是:
A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大
B.Y、Z的气态氢化物的热稳定性:HmY>HnZ
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知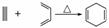 ,如果要合成,所用的起始原料可以是( )
,如果要合成,所用的起始原料可以是( )
A.2甲基1,3丁二烯和1丁炔
B.1,3戊二烯和2丁炔
C.2,3二甲基1,3戊二烯和乙炔
D.2,3二甲基1,3丁二烯和丙炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com